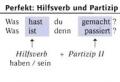
Bioszerves kémia. Bioszerves kémia tantárgy
Bioszerves kémia tantárgy.A szerves anyagok szerkezete és izomériája
kapcsolatokat.
Kémiai kötés és kölcsönhatás
atomok szerves vegyületekben.
A kémiai reakciók típusai.
Poli- és heterofunkcionális
kapcsolatokat.
Alapvető tankönyv – Tyukavkina N.A., Baukov Yu.I.
Bioszerves kémia.
Előadások szövege és kézikönyv „Bioorganic chemistry in
kérdések és válaszok" lásd a TSU honlapján: http://tgumed.ru
fül „Hallgatói súgó”, „Előadások a
a tanterv tudományágai." És természetesen VK
A bioszerves kémia az életfolyamatokban részt vevő anyagok szerkezetét és tulajdonságait vizsgálja biológiai ismeretükkel összefüggésben
A bioorganikus kémia az anyagok szerkezetét és tulajdonságait vizsgáljaéletfolyamatokban való részvétel, azzal kapcsolatban
biológiai funkcióik ismerete.
A kutatás fő tárgyai biológiaiak
polimerek (biopolimerek) és bioregulátorok.
Biopolimerek
–
nagy molekulatömegű
természetes
olyan vegyületek, amelyek minden élőlény szerkezeti alapját képezik
szervezetek és bizonyos szerepet játszanak a folyamatokban
élettevékenység. A biopolimerek közé tartoznak a peptidek és
fehérjék, poliszacharidok (szénhidrátok), nukleinsavak. BAN BEN
Ebbe a csoportba tartoznak a lipidek is, amelyek maguk nem
nagy molekulatömegű vegyületek, de in
a test általában más biopolimerekhez kapcsolódik.
A bioregulátorok olyan vegyületek, amelyek kémiailag
szabályozza az anyagcserét. Ide tartoznak a vitaminok,
hormonok, sok szintetikus biológiailag aktív
vegyületek, beleértve a gyógyszereket is.
A szervezetben végbemenő kémiai reakciók összességét anyagcserének vagy anyagcserének nevezik. A sejtekben termelődő anyagok
A szervezetben végbemenő kémiai reakciók összességeanyagcserének vagy anyagcserének nevezik. Anyagok
növények és állatok sejtjeiben, szöveteiben és szerveiben képződik
az anyagcsere során metabolitoknak nevezzük.
Az anyagcsere két irányt foglal magában - a katabolizmust és a
anabolizmus.
A katabolizmus a bekerülő anyagok lebomlási reakcióira utal
táplálékkal a szervezetbe. Általában a szerves vegyületek oxidációjával járnak, és folytatják a felszabadulást
energia.
Az anabolizmus összetett molekulák szintézise abból
egyszerűbbek, ami egy élő szervezet szerkezeti elemeinek kialakulását, megújulását eredményezi.
Az anyagcsere folyamatok enzimek részvételével mennek végbe,
azok. specifikus fehérjék, amelyek a sejtekben találhatók
szervezetben, és a biokémiai katalizátorok szerepét töltik be
folyamatok (biokatalizátorok).
Anyagcsere
katabolizmusanabolizmus
Biopolimerek bomlása
kiemeléssel
energia
Biopolimerek szintézise
felszívódással
energia
Glicerin és
zsírsav
A szerves vegyületek szerkezetelméletének alapelvei A.M. Butlerov
1. A molekulában lévő atomok egy bizonyosszekvenciák vegyértékük szerint.
A szénatom vegyértéke szerves anyagokban
kapcsolatok négy.
2. Az anyagok tulajdonságai nem csak attól függnek, hogy mitől
atomok és milyen mennyiségben szerepelnek a készítményben
molekulák, hanem azok sorrendje is
összekapcsolva egymással.
3. Az alkotó atomok vagy atomcsoportok
a molekulák kölcsönösen befolyásolják egymást, okozva
kémiai aktivitásától és reakciójától függ
molekulák képessége.
4. Az anyagok tulajdonságainak tanulmányozása lehetővé teszi azok meghatározását
kémiai szerkezete.
H o m o l o g h i c y r a y d
Homológsor
Számos szerkezetileg hasonló vegyület van
hasonló kémiai tulajdonságok, amelyekben az egyén
egy sorozat tagjai csak mennyiségben különböznek egymástól
a -CH2- csoportokat homológ sorozatnak nevezzük, és a csoportot
CH2 – homológiai különbség.
Bármely homológ sorozat tagjainak elsöprő hatása van
a legtöbb reakció ugyanúgy megy végbe (kivétel
csak a sorozat első tagjait alkotják). Ezért tudva
a sorozat egyetlen tagjának kémiai reakcióival lehetséges
nagy valószínűséggel azt állítják, hogy ugyanaz
típusú transzformációk a fennmaradó tagokkal is előfordulnak
homológ sorozat.
Bármely homológ sorozatra levezethető
az atomok közötti kapcsolatot tükröző általános képlet
szén és hidrogén e sorozat tagjaiban; ez a képlet
a homológ sorozat általános képletének nevezzük.
A szerves vegyületek osztályozása a szénváz szerkezete szerint
Szerves vegyületek osztályozása funkciós csoportok jelenléte szerint
Funkcionális csoportOsztály
Példa
halogénatomok (F, Cl, Br, I) halogénszármazékok CH3CH2Cl (klóretán)
hidroxil (-OH)
alkoholok (fenolok)
CH3CH2OH (etanol)
tiol vagy merkapto- (– tiolok (merkaptánok) CH3CH2SH (etántiol)
SН)
éteri (–O–)
éterek
CH3CH2–O–CH2CH3
(dietil
éter)
észter
karboxil –C UN
észterek
CH3CH2COOCH3 (metil-acetát)
karbonsavak CH3COOH (ecetsav)
amid –С ОНН2
amidok
karbonil (–C=O)
szulfo-(–SO3H)
amino-(-NH2)
aldehidek és
ketonok
szulfonsavak
aminok
nitro- (-NO2)
nitrovegyületek
savak
CH3CONH2 (acetamid)
CH3CHO (etanál)
CH3COCH3 (propanon)
СН3SO3Н (metánszulfonsav)
CH3CH2NH2
(etil-amin,
elsődleges amin)
CH3NHCH3
(dimetil-amin,
szekunder amin)
CH3CH2NO2 (nitroetán)
A szerves vegyületek nómenklatúrája
Szerves vegyületek izomerizmusa
Ha két vagy több egyedi anyag rendelkezikugyanaz a mennyiségi összetétel (molekulaképlet),
de a kötési sorrendben különböznek egymástól
atomok és (vagy) helyük a térben, akkor általában
Ebben az esetben izomereknek nevezzük.
Mivel ezeknek a vegyületeknek a szerkezete eltérő, akkor
izomerek kémiai vagy fizikai tulajdonságai
különbözők.
Az izoméria típusai: szerkezeti (szerkezeti izomerek) és
sztereoizoméria (térbeli).
A szerkezeti izoméria háromféle lehet:
- a szénváz izomériája (láncizomerek),
- helyzeti izomerek (többszörös kötés vagy funkcionális
csoportok),
- a funkciós csoport izomerjei (interclass).
A sztereoizoméria felosztása
konfigurációt
tovább
konformációs
És
Ez a geometriai izoméria
Sík polarizált fény
Az optikai aktivitás jelei:- aszimmetrikus szénatom jelenléte;
- molekuláris szimmetria elemek hiánya
Az adrenalin enantiomerjei
fehérje
Anionos
Lakás
központ
felület
nem foglalt
Lakás
Anionos
felület
központ
elfoglalt
(+) - adrenalin
(-)- adrenalin
befejezetlen
levelezés
alacsony
tevékenység
teljes
levelezés
magas
tevékenység
Az enantiomerek biológiai aktivitása
aszparaginDARVON
fájdalomcsillapító
NOVRAD
köhögéscsillapító gyógyszer
tükör
L-aszparagin
D-aszparagin
(spárgából)
(borsóból)
keserű íz
édes íz
enantiomerek
A talidomid áldozatai
Szerves vegyületek savassága és lúgossága
Bronsted savak (protikus savak) -semleges molekulák vagy ionok, amelyek képesek
protont adományozni (proton donorok).
A tipikus Brønsted-savak a karbonsavak
savak. Gyengébb savas tulajdonságaik vannak
fenolok és alkoholok hidroxilcsoportjai, valamint tio-,
amino- és iminocsoportok.
A Bronsted bázisok semleges molekulák ill
protont fogadni képes ionok (akceptorok
protonok).
A tipikus Bronsted-bázisok az aminok.
Amfolitok - vegyületek, molekulákban
amelyek egyaránt tartalmaznak savas és
fő csoportok.
Savak és bázisok típusai Brønsted szerint
A novokain molekula fő központjai
Az alapvető tulajdonságok felhasználása a gyógyszerek vízoldható formáinak előállítására
Alapvetőtulajdonságait
gyógyászati
drogok
vízoldható formáik előállítására használják.
Ha savakkal kölcsönhatásba lépnek, a vegyületek a
ionos kötések - vízben jól oldódó sók.
Igen, novokain injekcióhoz
hidroklorid formájában használják.
a legerősebb főközpont,
amelyhez a proton csatlakozott
Az anyagok sav-bázis tulajdonságai és a szervezetbe jutásuk
lipidmembrán
A gyomor pH-ja 1
UNS
lipid
membrán
vérplazma
pH 7,4
UNS
OSOSN3
A gyomor pH-ja 1
+
OSOSN3
NH3
SOOOOSCH3
SOO-
NH2
NH2
OSOSN3
Bél pH 7-8
vérplazma
pH 7,4
Bél pH 7-8
A savas gyógyszerek jobban felszívódnak a gyomorból (pH 1-3),
és a gyógyszerek vagy xenobiotikus bázisok felszívódása csak akkor történik meg
miután a gyomorból a belekbe jutnak (pH 7-8). Alatt
Egy óra alatt az acetilszalicilsav közel 60%-a felszívódik a patkányok gyomrából.
sav és csak 6% anilin a beadott adagból. Patkányok belében
A beadott anilin adag 56%-a már felszívódik. Ilyen gyenge alap
mint a koffein (рKВH + 0,8), felszívódik ugyanabban az időben egy sokkal nagyobb
fok (36%), hiszen a gyomor erősen savas környezetében is koffein
túlnyomórészt nem ionizált állapotban van.
Reakciók típusai a szerves kémiában
A szerves reakciókat a szerint osztályozzukkövetkező jelek:
1. A reagensek elektronikus jellege szerint.
2. A reakció során a részecskék számának változásával.
3. Konkrét jellemzők alapján.
4. Elemi mechanizmusok szerint
reakciók szakaszai.
A reagensek elektronikus jellegétől függően a reakciókat megkülönböztetjük: nukleofil, elektrofil és szabad gyökös reakciókat.
A szabad gyökök elektromosan semleges részecskékpárosítatlan elektronnal, például: Cl, NO2.
A szabad gyökös reakciók az alkánokra jellemzőek.
Az elektrofil reagensek kationok vagy molekulák
amelyek önmagukban vagy katalizátor jelenlétében
fokozott affinitásuk van egy elektronpárhoz ill
molekulák negatív töltésű központjai. Ezek tartalmazzák
H+, Cl+, +NO2, +SO3H, R+ kationok és szabad molekulák
pályák AlCl3, ZnCl2 stb.
Az elektrofil reakciók jellemzőek az alkénekre, alkinekre,
aromás vegyületek (addíció kettős kötésnél,
protonszubsztitúció).
A nukleofil reagensek olyan anionok vagy molekulák, amelyek
megnövekedett elektronsűrűségű központokkal. Nekik
anionok és molekulák, mint pl
HO-, RO-, Cl-, Br-, RCOO-, CN-, R-, NH3, C2H5OH stb. Változás által
során a részecskék száma
reakciókat különböztetjük meg
helyettesítési reakciók,
csatlakozások,
szétválás
(megszüntetés),
bomlás
A reakciók osztályozása sajátos jellemzők szerint
A reakciókészséget mindig figyelembe veszik
csak a reakciós partnerrel kapcsolatban.
Kémiai átalakulás során általában
nem az egész molekulát érinti, hanem annak csak egy részét -
reakcióközpont.
Egy szerves vegyület tartalmazhat
több egyenlőtlen reakcióközpont.
A reakciók izomer termékekhez vezethetnek.
Reakciószelektivitás – kvalitatív
jellemző jelentés uralkodó
a reakció az egyik irányba halad
több lehetséges.
Vannak regioszelektivitások,
kemoszelektivitás, a reakció sztereoszelektivitása.
A reakciók szelektivitása a szerves kémiában
Regioszelektivitás - preferenciális reakció szerintegy molekula több reakciócentruma közül az egyik.
CH3-CH2-CH3 + Br2
СН3-СНВr-СН3 + НВr
A második izomer, az 1-bróm-propán gyakorlatilag nem képződik.
Kemoszelektivitás - preferenciális reakció szerint
az egyik kapcsolódó funkciós csoport.
Sztereoszelektivitás - preferenciális képződés a reakcióban
egyike a lehetséges sztereoizomereknek. A többfunkciós vegyületek tartalmaznak
több azonos funkciós csoport.
A heterofunkcionális vegyületek tartalmaznak
több különböző funkciós csoport.
Heteropolifunkcionális
a vegyületek mindkettőt tartalmazzák
más és ugyanaz
funkcionális csoportok.
Poli- és heterofunkciós vegyületek tulajdonságai
Minden csoport poli- és heterofunkcionálisvegyületek ugyanazon reakciókon menhetnek keresztül, mint
megfelelő csoport monofunkcionális
kapcsolatokat Sajátos tulajdonságai poli- és
heterofunkcionális vegyületek
Ciklizációs reakciók
Kelát komplexek képződése Többfunkciós vegyületek, mint antidotumok
A nehézfémek mérgező hatása az
fehérjék tiolcsoportjainak megkötése. Ennek eredményeként gátolják őket
a szervezet létfontosságú enzimjei.
Az ellenszerek hatásának elve az erősek kialakulása
komplexek nehézfém-ionokkal.
A modern bioorganikus kémia elágazó tudományterület, számos orvosbiológiai tudományág alapja, és mindenekelőtt a biokémia, molekuláris biológia, genomika, proteomika és
bioinformatika, immunológia, farmakológia.
A program azon a szisztematikus megközelítésen alapul, hogy a teljes tanfolyamot egyetlen elméleti alapon építik fel.
az organikus elektronikus és térbeli szerkezetére vonatkozó elképzeléseken alapuló alapokon
vegyületek és kémiai átalakulásuk mechanizmusai. Az anyagot 5 rész formájában mutatjuk be, amelyek közül a legfontosabbak: „A szerves vegyületek szerkezetének elméleti alapjai és reakcióképességüket meghatározó tényezők”, „A szerves vegyületek biológiailag fontos osztályai” és „Biopolimerek és szerkezeti összetevőik. Lipidek"
A program a bioszerves kémia speciális oktatását célozza egy orvosi egyetemen, ezért a tudományágat „bioszerves kémia az orvostudományban”-nak nevezik. A bioszerves kémia oktatásának profilalkotását szolgálja az orvostudomány és a kémia fejlődésének történeti kapcsolatának figyelembevétele, ezen belül a szerves, fokozott figyelem a biológiailag fontos szerves vegyületek osztályaira (heterofunkcionális vegyületek, heterociklusok, szénhidrátok, aminosavak és fehérjék, nukleinsavak). savak, lipidek), valamint ezen vegyületcsoportok biológiailag fontos reakciói). A program külön szakasza foglalkozik bizonyos szerves vegyületcsoportok farmakológiai tulajdonságaival és egyes gyógyszercsoportok kémiai természetével.
Figyelembe véve az „oxidatív stressz betegségek” fontos szerepét a modern emberi morbiditás szerkezetében, a program kiemelt figyelmet fordít a szabadgyök-oxidációs reakciókra, a szabadgyökös lipidoxidáció végtermékeinek kimutatására a laboratóriumi diagnosztikában, a természetes antioxidánsokra és antioxidáns gyógyszerekre. A program figyelembe veszi a környezeti problémákat, nevezetesen a xenobiotikumok természetét és az élő szervezetekre gyakorolt toxikus hatásuk mechanizmusait.
1. A képzés célja és célkitűzései.
1.1. A bioszerves kémia az orvostudományban tantárgy oktatásának célja a bioszerves kémia, mint a modern biológia alapjaként betöltött szerepének megértése, elméleti alapja a bioorganikus vegyületek biológiai hatásainak, a gyógyszerek hatásmechanizmusainak, valamint a biokémiai anyagok létrejöttének magyarázatának. új gyógyszerek. A legfontosabb bioszerves vegyületcsoportok szerkezete, kémiai tulajdonságai és biológiai aktivitása közötti összefüggések ismeretének fejlesztése, a megszerzett ismeretek alkalmazásának megtanítása a későbbi tudományágak tanulmányozása során és a szakmai tevékenységek során.
1.2. A bioszerves kémia oktatásának céljai:
1. A bioszerves vegyületek legfontosabb osztályainak szerkezetére, tulajdonságaira és reakciómechanizmusaira vonatkozó ismeretek formálása, amelyek meghatározzák azok gyógyászati és biológiai jelentőségét.
2. Elképzelések kialakítása a szerves vegyületek elektron- és térszerkezetéről, kémiai tulajdonságaik és biológiai aktivitásuk magyarázatának alapjául.
3. Készségek és gyakorlati készségek kialakítása:
osztályozza a bioorganikus vegyületeket a szénváz szerkezete és a funkciós csoportok szerint;
használja a kémiai nómenklatúra szabályait a metabolitok, gyógyszerek, xenobiotikumok nevének feltüntetésére;
azonosítani a reakcióközpontokat a molekulákban;
képes legyen olyan kvalitatív reakciókat végrehajtani, amelyek klinikai és laboratóriumi jelentőséggel bírnak.
2. A fegyelem helye az OOP felépítésében:
A "Bioorganikus kémia" tudományág a "kémia" tudományág szerves része, amely a tudományágak matematikai, természettudományi ciklusába tartozik.
A tudományág tanulmányozásához szükséges alapismeretek a matematikai, természettudományi diszciplínák ciklusában alakulnak ki: fizika, matematika; orvosi informatika; kémia; biológia; anatómia, szövettan, embriológia, citológia; normál fiziológia; mikrobiológia, virológia.
A tudományágak tanulmányozásának előfeltétele:
biokémia;
gyógyszertan;
mikrobiológia, virológia;
immunológia;
szakmai diszciplínák.
Párhuzamosan tanult, interdiszciplináris kapcsolatokat biztosító tudományágak a tananyag alaprészének keretein belül:
kémia, fizika, biológia, 3. Azon tudományágak és témák listája, amelyeket a tanulóknak el kell sajátítaniuk a bioszerves kémia tanulmányozásához.
Általános kémia. Az atom szerkezete, a kémiai kötés természete, a kötések típusai, a kémiai anyagok osztályai, a reakciók típusai, katalízis, a közeg reakciója vizes oldatokban.
Szerves kémia. Szerves anyagok osztályai, a szerves vegyületek nómenklatúrája, a szénatom konfigurációja, az atompályák polarizációja, szigma és pi kötések. A szerves vegyületek osztályainak genetikai kapcsolata. A szerves vegyületek különböző osztályainak reakciókészsége.
Fizika. Az atom szerkezete. Optika - a spektrum ultraibolya, látható és infravörös tartományai.
A fény kölcsönhatása az anyaggal - áteresztés, elnyelés, visszaverődés, szórás. Polarizált fény.
Biológia. Genetikai kód. Az öröklődés és változékonyság kémiai alapjai.
latin nyelv. A terminológia elsajátítása.
Idegen nyelv. Külföldi irodalommal való munkavégzés képessége.
4. A tudományág szakaszai és interdiszciplináris kapcsolatok a nyújtott (utólagos) tudományágak száma A tudományág tanulmányozásához szükséges szakaszok száma A megadott résztudományok (utóbbi) tudományágak (utóbbi) tudományágak neve 1 2 3 4 5 1 Kémia + + + + + Biológia + - - + + Biokémia + + + + + + 4 Mikrobiológia, virológia + + - + + + 5 Immunológia + - - - + Farmakológia + + - + + + 7 Higiénia + - + + + Szakmai tudományágak + - - + + + + 5. a szakterület tartalmának elsajátítása A tanulási cél elérése A „Bioszerves kémia” tudományág számos célzott problémafeladat megvalósítását foglalja magában, melynek eredményeként a tanulóknak fejleszteniük kell bizonyos kompetenciákat, ismereteket, készségeket, és el kell sajátítaniuk bizonyos gyakorlati készségeket.
5.1. A tanulónak rendelkeznie kell:
5.1.1. Általános kulturális kompetenciák:
képesség és hajlandóság a társadalmilag jelentős problémák és folyamatok elemzésére, a bölcsészettudományi, természettudományi, orvosbiológiai és klinikai tudományok módszereinek gyakorlati alkalmazására a különböző típusú szakmai és társadalmi tevékenységekben (OK-1);
5.1.2. Szakmai kompetenciák (PC):
a tudományos és szakmai információk megszerzésének, tárolásának, feldolgozásának alapvető módszereinek, módszereinek és eszközeinek alkalmazására való képesség és hajlandóság; különböző forrásokból információkat kaphat, beleértve a modern számítógépes eszközök, hálózati technológiák, adatbázisok használatát, valamint képességet és hajlandóságot a tudományos irodalommal való munkavégzésre, az információk elemzésére, a keresésekre, az olvasottakat szakmai problémák megoldásának eszközévé alakítani (kiemelje ki a fő rendelkezések, az azokból származó következmények és javaslatok);
részvételi képesség és készség tudományos problémák felállításában és kísérleti megvalósításában (PC-2, PC-3, PC-5, PC-7).
5.2. A tanulónak tudnia kell:
A szerves vegyületek osztályozásának, nómenklatúrájának és izomériájának elvei.
Az elméleti szerves kémia alapjai, amelyek a szerves vegyületek szerkezetének és reakcióképességének vizsgálatának alapját képezik.
A szerves molekulák tér- és elektronszerkezete, valamint az életfolyamatokban résztvevő anyagok kémiai átalakulásai, közvetlen összefüggésben biológiai szerkezetükkel, kémiai tulajdonságaikkal és a biológiailag fontos szerves vegyületek főbb osztályainak biológiai szerepével.
5.3. A tanulónak képesnek kell lennie:
Osztályozza a szerves vegyületeket a szénváz szerkezete és a funkciós csoportok jellege szerint!
Állítsa össze a képleteket név szerint, és nevezze meg a biológiailag fontos anyagok és gyógyszerek jellemző képviselőit szerkezeti képlet alapján.
A szerves vegyületek kémiai viselkedésének meghatározásához azonosítsa a molekulákban található funkciós csoportokat, savas és bázikus centrumokat, konjugált és aromás fragmentumokat.
Megjósolni a szerves vegyületek kémiai átalakulásának irányát és eredményét.
5.4. A tanulónak rendelkeznie kell:
Az oktatási, tudományos és referencia irodalommal való önálló munka készsége; végezzen keresést és vonjon le általános következtetéseket.
Legyen jártas a vegyi üvegedények kezelésében.
Rendelkeznie kell a vegyi laboratóriumban való biztonságos munkavégzéshez, valamint a maró, mérgező, erősen illékony szerves vegyületek kezelésének, égőkkel, alkohollámpákkal és elektromos fűtőberendezésekkel való munkavégzésének képességével.
5.5. A tudáskontroll formái 5.5.1. Jelenlegi vezérlés:
Az anyagasszimiláció diagnosztikai ellenőrzése. Főleg a képletanyag ismeretének ellenőrzése érdekében időszakosan végzik.
Oktatási számítógépes vezérlés minden órán.
Az elemzési és általánosítási képességet igénylő tesztfeladatok (lásd Melléklet).
Ütemezett kollokviumok a program nagy részeinek tanulmányozásának befejezése után (lásd a mellékletet).
5.5.2 Végső ellenőrzés:
Teszt (két szakaszban végrehajtva):
C.2 – Matematikai, természettudományi és orvosbiológiai Általános munkaintenzitás:
2 Osztályozás, nómenklatúra és Szerves modern fizikai vegyületek osztályozási és osztályozási jellemzői: a szénváz szerkezete és a funkciós csoport jellege.
kémiai módszerek Funkcionális csoportok, szerves gyökök. A szerves vegyületek bioorganikus osztályainak biológiailag fontos vizsgálata: alkoholok, fenolok, tiolok, éterek, szulfidok, aldehid vegyületek, ketonok, karbonsavak és származékaik, szulfonsavak.
IUPAC nómenklatúra. A nemzetközi nómenklatúra változatai: helyettesítő és radikális-funkcionális nómenklatúra. A tudás értéke 3 A szerves vegyületek szerkezetének elméleti alapjai és A. M. Butlerov A szerves vegyületek szerkezetének elmélete. A pozíciójukat meghatározó fő tényezők. Szerkezeti képletek. A szénatom természete helyzet és reakcióképesség szerint. láncok. Az izomerizmus, mint a szerves kémia sajátos jelensége. A sztereoizoméria típusai.
A szerves vegyületek molekuláinak kiralitása, mint az optikai izoméria oka. Egy kiralitási centrummal rendelkező molekulák sztereoizomériája (enantiomerizmus). Optikai tevékenység. Gliceraldehid, mint konfigurációs szabvány. Fischer vetületi képletek. A sztereokémiai nómenklatúra D és L rendszere. Ötletek az R, S-nómenklatúráról.
Két vagy több kiralitási centrummal rendelkező molekulák sztereoizomériája: enantiomerizmus és diasztereomerizmus.
Sztereoizoméria kettős kötéssel rendelkező vegyületek sorozatában (Pydiastereomerizmus). Cisz és transz izomerek. A szerves vegyületek sztereoizomériája és biológiai aktivitása.
Az atomok kölcsönös hatása: előfordulási okai, típusai és átvitelének módjai a szerves vegyületek molekuláiban.
Párosítás. Párosítás nyitott áramkörökben (Pi-Pi). Konjugált kötések. Diénszerkezetek biológiailag fontos vegyületekben: 1,3-diének (butadién), poliének, alfa, béta-telítetlen karbonilvegyületek, karboxilcsoport. A csatolás mint rendszerstabilizációs tényező. Konjugációs energia. Konjugáció arénokban (Pi-Pi) és heterociklusokban (p-Pi).
Aromás. Aromás kritériumok. Benzenoid (benzol, naftalin, antracén, fenantrén) és heterociklusos (furán, tiofén, pirrol, imidazol, piridin, pirimidin, purin) vegyületek aromássága. Konjugált szerkezetek széles körben elterjedt előfordulása biológiailag fontos molekulákban (porfin, hem stb.).
Kötési polarizáció és elektronikus hatások (induktív és mezomer), mint az elektronsűrűség egyenetlen eloszlásának oka a molekulában. A szubsztituensek elektrondonorok és elektronakceptorok.
A legfontosabb szubsztituensek és elektronikus hatásaik. A szubsztituensek elektronikus hatásai és a molekulák reaktivitása. Orientációs szabály a benzolgyűrűben, első és második típusú szubsztituensek.
Szerves vegyületek savassága és lúgossága.
Hidrogéntartalmú funkciós csoportokkal rendelkező szerves vegyületek (aminok, alkoholok, tiolok, fenolok, karbonsavak) semleges molekuláinak savassága és bázikussága. Savak és bázisok Bronsted-Lowry és Lewis szerint. Konjugált savak és bázisok párjai. Anion savasság és stabilitás. Szerves vegyületek savasságának kvantitatív értékelése Ka és pKa értékek alapján.
A szerves vegyületek különböző osztályainak savassága. A szerves vegyületek savasságát meghatározó tényezők: a nemfém atom elektronegativitása (C-H, N-H és O-H savak); nemfém atomok polarizálhatósága (alkoholok és tiolok, tiolmérgek); a gyök természete (alkoholok, fenolok, karbonsavak).
Szerves vegyületek bázikussága. n-bázisok (heterociklusok) és pi-bázisok (alkének, alkándiének, arének). A szerves vegyületek bázikusságát meghatározó tényezők: a heteroatom elektronegativitása (O- és N bázisok); nemfém atom polarizálhatósága (O- és S-bázis); a gyök természete (alifás és aromás aminok).
A semleges szerves molekulák sav-bázis tulajdonságainak jelentősége reaktivitásuk és biológiai aktivitásuk szempontjából.
A hidrogénkötés, mint a sav-bázis tulajdonságok sajátos megnyilvánulása. A szerves vegyületek reakciókészségének általános mintázata, mint biológiai működésük kémiai alapja.
Szerves vegyületek reakciómechanizmusai.
A szerves vegyületek reakcióinak osztályozása a szubsztitúció, addíció, elimináció, átrendeződés, redox eredménye és a mechanizmus szerint - gyökös, ionos (elektrofil, nukleofil). A kovalens kötés hasításának típusai szerves vegyületekben és a keletkező részecskékben: homolitikus hasítás (szabad gyökök) és heterolitikus hasítás (karbokationok és karbonanionok).
Ezen részecskék elektron- és térbeli szerkezete és relatív stabilitásukat meghatározó tényezők.
Homolitikus gyökös szubsztitúciós reakciók alkánokban az sp 3-hibridizált szénatom C-H kötéseivel. Szabadgyök oxidációs reakciók élő sejtben. Az oxigén reaktív (gyökös) formái. Antioxidánsok. Biológiai jelentősége.
Elektrofil addíciós reakciók (Ae): a Pi-kötést érintő heterolitikus reakciók. Az etilén halogénezési és hidratációs reakcióinak mechanizmusa. Savas katalízis. Statikus és dinamikus tényezők hatása a reakciók regioszelektivitására. Hidrogéntartalmú anyagok Pi-kötéshez való addíciós reakcióinak sajátosságai aszimmetrikus alkénekben. Markovnikov uralma. A konjugált rendszerek elektrofil addíciójának jellemzői.
Elektrofil szubsztitúciós reakciók (Se): heterolitikus reakciók, amelyekben egy aromás rendszer vesz részt. Elektrofil szubsztitúciós reakciók mechanizmusa arénekben. Szigma komplexek. Arénok alkilezési, acilezési, nitrálási, szulfonálási, halogénezési reakciói. Tájékozódási szabály.
1. és 2. típusú helyettesítők. Az elektrofil szubsztitúciós reakciók jellemzői heterociklusokban. A heteroatomok orientáló hatása.
Nukleofil szubsztitúció (Sn) reakciói sp3-hibridizált szénatomon: a szén-heteroatom szigma kötés polarizációja által kiváltott heterolitikus reakciók (halogén származékok, alkoholok). Elektronikus és térbeli tényezők hatása a vegyületek reaktivitására nukleofil szubsztitúciós reakciókban.
Halogénszármazékok hidrolízis reakciója. Alkoholok, fenolok, tiolok, szulfidok, ammónia és aminok alkilezési reakciói. A savas katalízis szerepe a hidroxilcsoport nukleofil szubsztitúciójában.
Primer aminocsoportot tartalmazó vegyületek dezaminálása. Az alkilezési reakciók biológiai szerepe.
Eliminációs reakciók (dehidrohalogénezés, dehidratáció).
A megnövekedett CH savasság, mint az sp3-hibridizált szénatom nukleofil szubsztitúcióját kísérő eliminációs reakciók oka.
Nukleofil addíciós reakciók (An): heterolitikus reakciók, amelyekben a pi szén-oxigén kötés (aldehidek, ketonok) vesz részt. A karbonilvegyületek osztályai. képviselői. Aldehidek, ketonok, karbonsavak előállítása. A karbonilcsoport szerkezete és reakcióképessége. Elektronikus és térbeli tényezők hatása. An reakciók mechanizmusa: a protonálódás szerepe a karbonil reaktivitás növelésében. Aldehidek és ketonok biológiailag fontos reakciói: hidrogénezés, aldehidek oxidáció-redukciója (diszmutációs reakció), aldehidek oxidációja, cianohidrinek képződése, hidratáció, hemiacetálok, iminek képződése. Aldol addíciós reakciók. Biológiai jelentősége.
Nukleofil szubsztitúciós reakciók az sp2-hibridizált szénatomon (karbonsavak és funkcionális származékaik).
Nukleofil szubsztitúciós reakciók (Sn) mechanizmusa az sp2 hibridizált szénatomon. Acilezési reakciók - anhidridek, észterek, tioészterek, amidok képződése - és ezek fordított hidrolízisi reakciói. Az acilezési reakciók biológiai szerepe. A karbonsavak savas tulajdonságai az O-H csoport szerint.
Szerves vegyületek oxidációs és redukciós reakciói.
Redox reakciók, elektronikus mechanizmus.
A szénatomok oxidációs állapotai szerves vegyületekben. Primer, szekunder és tercier szénatomok oxidációja. A szerves vegyületek különböző osztályainak oxidálhatósága. Az oxigén felhasználás módjai a sejtben.
Energetikai oxidáció. Oxidáz reakciók. A szerves anyagok oxidációja a kemotrófok fő energiaforrása. Műanyag oxidáció.
4 A szerves vegyületek biológiailag fontos osztályai Többértékű alkoholok: etilénglikol, glicerin, inozitol. Oktatás Hidroxisavak: osztályozás, nómenklatúra, tejsav, bétahidroxivajsav, gammahidroxivajsav, almasav, borkősav, citromsav, reduktív aminálás, transzaminálás és dekarboxiláció képviselői.
Aminosavak: osztályozás, béta- és gamma-izomerek képviselői: aminopropán, gamma-aminovajsav, epszilonaminokapronsav. Reakció A szalicilsav és származékai (acetilszalicilsav, lázcsillapító, gyulladás- és reumacsökkentő szer, enteroseptol és 5-NOK. Az izokinolin mag, mint az ópium alkaloidok, görcsoldók (papaverin) és fájdalomcsillapítók (morfin) alapja. Az akridin származékok fertőtlenítőszerek.
xantin származékok - koffein, teobromin és teofillin, indol származékok rezerpin, sztrichnin, pilokarpin, kinolin származékok - kinin, izokinolin morfin és papaverin.
a cefalosproinok a cefalosporánsav származékai, a tetraciklinek a naftacén származékai, a sztreptomicinek az amiloglikozidok. Félszintetikus 5 Biopolimerek és szerkezeti komponenseik. Lipidek. Meghatározás. Osztályozás. Funkciók.
Ciklo-oxotautomerizmus. Mutarotáció. Monoszacharidok származékai dezoxicukor (dezoxiribóz) és aminocukor (glükózamin, galaktózamin).
Oligoszacharidok. Disacharidok: maltóz, laktóz, szacharóz. Szerkezet. Oglikozidos kötés. Helyreállító tulajdonságok. Hidrolízis. Biológiai (az aminosavak lebontásának útja); gyökös reakciók - hidroxilezés (aminosavak oxi-származékainak képződése). Peptidkötés kialakulása.
Peptidek. Meghatározás. A peptidcsoport felépítése. Funkciók.
Biológiailag aktív peptidek: glutation, oxitocin, vazopresszin, glukagon, neuropeptidek, kinin peptidek, immunoaktív peptidek (timozin), gyulladásos peptidek (difexin). A citokinek fogalma. Antibiotikus peptidek (gramicidin, aktinomicin D, ciklosporin A). Peptid toxinok. A peptidek biológiai hatásai és bizonyos aminosavmaradékok kapcsolata.
Mókusok. Meghatározás. Funkciók. A fehérje szerkezetének szintjei. Az elsődleges szerkezet az aminosavak sorrendje. Kutatási módszerek. A fehérjék részleges és teljes hidrolízise. A fehérjék elsődleges szerkezetének meghatározásának jelentősége.
Irányított helyspecifikus mutagenezis, mint módszer a fehérjék funkcionális aktivitása és az elsődleges szerkezet közötti kapcsolat vizsgálatára. A fehérjék elsődleges szerkezetének veleszületett rendellenességei - pontmutációk. Másodlagos szerkezet és típusai (alfa hélix, béta szerkezet). Harmadlagos szerkezet.
Denaturáció. Az aktív központok fogalma. Oligomer fehérjék kvaterner szerkezete. Szövetkezeti ingatlanok. Egyszerű és összetett fehérjék: glikoproteinek, lipoproteinek, nukleoproteinek, foszfoproteinek, metalloproteinek, kromoproteinek.
Nitrogénbázisok, nukleozidok, nukleotidok és nukleinsavak.
A nitrogénbázis, a nukleozid, a nukleotid és a nukleinsav fogalmak meghatározása. Purin (adenin és guanin) és pirimidin (uracil, timin, citozin) nitrogéntartalmú bázisok. Aromás tulajdonságok. Az oxidatív lebontással szembeni ellenállás, mint a biológiai szerep betöltésének alapja.
Lactim - laktám tautoméria. Kisebb mennyiségű nitrogéntartalmú bázisok (hipoxantin, 3-N-metil-uracil stb.). Nitrogéntartalmú bázisok származékai - antimetabolitok (5-fluorouracil, 6-merkaptopurin).
Nukleozidok. Meghatározás. Glikozid kötés kialakulása nitrogéntartalmú bázis és pentóz között. Nukleozidok hidrolízise. Nukleozid antimetabolitok (adenin-arabinozid).
Nukleotidok. Meghatározás. Szerkezet. Foszfoészter kötés kialakulása a pentóz C5 hidroxilcsoportjának foszforsavval történő észterezése során. Nukleotidok hidrolízise. Makroerg nukleotidok (nukleozid polifoszfátok - ADP, ATP stb.). Nukleotidok-koenzimek (NAD+, FAD), B5 és B2 vitaminok szerkezete, szerepe.
Nukleinsavak - RNS és DNS. Meghatározás. Az RNS és a DNS nukleotid összetétele. Elsődleges szerkezet. Foszfodiészter kötés. Nukleinsavak hidrolízise. A triplet (kodon), gén (cisztron), genetikai kód (genom) fogalmak meghatározása. Nemzetközi Humán Genom Projekt.
A DNS másodlagos szerkezete. A hidrogénkötések szerepe a másodlagos szerkezet kialakításában. Nitrogéntartalmú bázisok komplementer párjai. A DNS harmadlagos szerkezete. A nukleinsavak szerkezetének megváltozása vegyszerek hatására. A mutagén anyagok fogalma.
Lipidek. Definíció, osztályozás. Elszappanosítható és el nem szappanosítható lipidek.
A természetes magasabb zsírsavak a lipidek összetevői. Legfontosabb képviselői: palmitinsav, sztearinsav, olajsav, linolsav, linolénsav, arachidonsav, eikozapentaén, dokozohexaén (F-vitamin).
Semleges lipidek. Acilglicerolok – természetes zsírok, olajok, viaszok.
Mesterséges ehető hidrozsírok. Az acilglicerinek biológiai szerepe.
Foszfolipidek. Foszfatidinsavak. Foszfatidilkolinok, foszfatidietanol-aminok és foszfatidil-szerinek. Szerkezet. Részvétel a biológiai membránok kialakításában. Lipid-peroxidáció a sejtmembránokban.
Szfingolipidek. Szfingozin és szfingomielinek. Glikolipidek (cerebrozidok, szulfatidok és gangliozidok).
El nem szappanosítható lipidek. Terpének. Mono- és biciklusos terpének 6 Farmakológiai tulajdonságok A monopoli és egyes heterofunkcionális vegyületek osztályainak farmakológiai tulajdonságai (hidrogén-halogenidek, alkoholok, oxi- és szerves vegyületek. oxosavak, benzolszármazékok, heterociklusok, alkaloidok.). Kémiai Egyes gyulladáscsökkentő gyógyszerek, fájdalomcsillapítók, antiszeptikumok és gyógyszercsoportok kémiai természete. antibiotikumok.
6.3. Tantárgyi szekciók és óratípusok 1. Bevezetés a tantárgyba. A bioszerves vegyületek osztályozása, nómenklatúrája és kutatása 2. A szerves reakcióképesség szerkezetének elméleti alapjai.
3. A szerves vegyületek biológiailag fontos osztályai 5 A szerves vegyületek egyes osztályainak farmakológiai tulajdonságai. Egyes gyógyszercsoportok kémiai természete L-előadások; PZ – gyakorlati gyakorlatok; LR – laboratóriumi munka; C – szemináriumok; SRS – a tanulók önálló munkája;
6.4 Tantárgyi előadások tematikus terve 1 1 Bevezetés a tantárgyba. A bioszerves kémia fejlődéstörténete, jelentősége 3 2 A szerves vegyületek szerkezetének elmélete A. M. Butlerov. Az izomerizmus mint 4 2 Az atomok kölcsönös hatása: előfordulási okai, átvitelének típusai és módszerei 7-ben 1.2 Tesztmunka a „Bioszerves vegyületek osztályozása, nómenklatúrája és modern fizikokémiai módszerek” és „A szerves vegyületek szerkezetének elméleti alapjai” fejezetekben. és reakciójukat meghatározó tényezők 15 5 A szerves vegyületek egyes osztályainak farmakológiai tulajdonságai. Kémiai 19 4 14 Magasabb karbonátok oldhatatlan kalciumsóinak kimutatása 1 1 Bevezetés a témába. Osztályozás és munka az ajánlott irodalommal.
bioorganikus vegyületek nómenklatúrája. Írásbeli feladat készítése 3 2 Atomok kölcsönös hatása molekulákban Munka ajánlott irodalommal.
4 2 Szerves anyagok savassága és lúgossága Az ajánlott irodalommal dolgozzon.
5 2 Szerves reakciók mechanizmusai Az ajánlott irodalom felhasználása.
6 2 Szerves anyagok oxidációja és redukciója Munka az ajánlott irodalommal.
7 1.2 Tesztmunka szakaszonként Munkavégzés ajánlott irodalommal. * korszerű fizikai és kémiai módszerek a javasolt témákban, kutatások végzése bioszerves vegyületekkel kapcsolatban, információkeresés különböző szerves vegyületekben és tényezőkben, INTERNET és munka angol nyelvű adatbázisokkal 8 3 Heterofunctional bioorganic Munka ajánlott irodalommal.
9 3 Biológiailag fontos heterociklusok. Dolgozzon az ajánlott irodalommal.
10 3 Vitaminok (laboratóriumi munka). Dolgozzon az ajánlott irodalommal.
12 4 Alfa aminosavak, peptidek és fehérjék. Dolgozzon az ajánlott irodalommal.
13 4 Nitrogénbázisok, nukleozidok, Munka ajánlott irodalommal.
nukleotidok és nukleinsavak. Írásbeli írásbeli feladat megoldása 15 5 Egyesek farmakológiai tulajdonságai Munka az ajánlott irodalommal.
szerves vegyületek osztályai. Írásbeli írásbeli feladat készítése Egyes gyógyászati * kémiai képletek egyes osztályainak kémiai jellege - a tanuló által választott feladatok.
szerves vegyületek.
szerves molekulák.
szerves molekulák.
szerves vegyületek.
szerves vegyületek.
kapcsolatokat. Sztereoizoméria.
bizonyos gyógyszercsoportok.
A félév során egy hallgató a gyakorlati órákon maximum 65 pontot szerezhet.
Egy gyakorlati órán egy tanuló maximum 4,3 pontot szerezhet. Ez a szám az óralátogatásért (0,6 pont), a tanórán kívüli önálló munkavégzésért (1,0 pont), a laboratóriumi munkáért (0,4 pont) és a szóbeli feleletért és a tesztfeladatért kapott pontokból (1,3-tól 1,3 pontig) kapott pontokból áll. 2,3 pont). Az órákon való részvételért, a tanórán kívüli önálló munkavégzésért és a laboratóriumi munkákért pontokat adunk „igen” - „nem” alapon. A szóbeli válasz és a tesztfeladat 1,3-tól 2,3 pontig különböztethető meg pozitív válasz esetén: 0-1,29 pont a „nem kielégítő”, 1,3-1,59 - „megfelelő”, 1,6-1,99 – „jó” minősítésnek felel meg. ”, 2,0-2,3 – „kiváló”. A teszten egy tanuló maximum 5,0 pontot érhet el: óralátogatás 0,6, szóbeli válaszadás 2,0-4,4 pont.
A vizsgára való felvételhez a tanulónak legalább 45 pontot kell szereznie, míg a hallgató jelenlegi teljesítményét a következőképpen értékelik: 65-75 pont – „kiváló”, 54-64 pont – „jó”, 45-53 pont – „ kielégítő”, 45 pont alatti – nem kielégítő. Ha egy tanuló 65-75 pontot ér el ("kiváló" eredmény), akkor mentesül a teszt alól, és automatikusan "megfelelt" jegyet kap az osztályzatba, amivel 25 pontot kap a tesztért.
A teszten egy tanuló maximum 25 pontot szerezhet: 0-15,9 pont a „nem kielégítő”, 16-17,5 – „kielégítő”, 17,6-21,2 – „jó”, 21,3-25 – „Remek” osztályzatnak felel meg.
A bónuszpontok felosztása (összesen 10 pont szemeszterenként) 1. Előadáslátogatás – 0,4 pont (100% előadáslátogatás – 6,4 pont szemeszterenként);
2. Részvétel az UIRS-ben 3 pontig, beleértve:
absztrakt írása a javasolt témában – 0,3 pont;
beszámoló és multimédiás előadás készítése a záró oktatási és elméleti konferenciára 3. Kutatómunkában való részvétel – 5 pontig, beleértve:
a tanszéki hallgatói tudományos kör ülésén való részvétel - 0,3 pont;
beszámoló elkészítése a hallgatói tudományos kör ülésére – 0,5 pont;
tudósítás egyetemi hallgatói tudományos konferencián – 1 pont;
előadás regionális, össz-oroszországi és nemzetközi hallgatói tudományos konferencián – 3 pont;
publikáció tudományos diákköri konferenciák gyűjteményeiben – 2 pont;
publikáció lektorált tudományos folyóiratban – 5 pont;
4. Részvétel a tanszéki oktatómunkában 3 pontig, beleértve:
a tanszéken kívüli órákban végzett oktatási tevékenység szervezésében való részvétel - egy rendezvényért 2 pont;
tanórán kívüli órákban a tanszék által tartott oktatási foglalkozásokon való részvétel – egy rendezvényért 1 pont;
A büntetőpontok felosztása (félévente összesen 10 pontig) 1. Az előadásokról igazolatlan okból való távolmaradás - 0,66-0,67 pont (0%-os előadásokon való részvétel - 10 pont a Ha a hallgató alapos okból hiányzott egy tanóráról, joga van kidolgozni a leckét, hogy javítsa jelenlegi értékelését.
Ha a hiányzás igazolatlan, a tanulónak az órát teljesítenie kell, és 0,8-as csökkentő tényezővel osztályzatot kell kapnia.
Ha a hallgató a tanórákon való fizikai jelenlét alól mentesül (az akadémia rendelete alapján), akkor a tanórán kívüli önálló munkavégzésért maximális pontszám jár.
6. A tudományág oktatási, módszertani és információs támogatása 1. N.A. Tyukavkina, Yu.I. Baukov, S.E. Zurabyan. Bioszerves kémia. M.:DROFA, 2009.
2. Tyukavkina N.A., Baukov Yu.I. Bioszerves kémia. M.:DROFA, 2005.
1. Ovchinikov Yu.A. Bioszerves kémia. M.: Oktatás, 1987.
2. Riles A., Smith K., Ward R. A szerves kémia alapjai. M.: Mir, 1983.
3. Shcherbak I.G. Biológiai kémia. Tankönyv orvosi egyetemeknek. S.-P. Szentpétervári Állami Orvostudományi Egyetem kiadója, 2005.
4. Berezov T.T., Korovkin B.F. Biológiai kémia. M.: Orvostudomány, 2004.
5. Berezov T.T., Korovkin B.F. Biológiai kémia. M.: Orvostudomány, Postupaev V.V., Ryabtseva E.G. Sejtmembránok biokémiai szervezése (tankönyv orvosi egyetemek gyógyszerészeti karának hallgatói számára). Habarovszk, Távol-Kelet Állami Orvostudományi Egyetem. 2001
7. Soros ismeretterjesztő folyóirat, 1996-2001.
8. Útmutató a bioszerves kémia laboratóriumi órákhoz. Szerkesztette: N. A. Tyukavkina, M.:
Orvostudomány, 7.3 Tanszék által készített oktatási és módszertani anyagok 1. Bioszerves kémia gyakorlati foglalkozások módszertani fejlesztése hallgatók számára.
2. Módszertani fejlesztések a tanulók önálló tanórán kívüli munkájához.
3. Borodin E.A., Borodina G.P. Biokémiai diagnózis (a vér és a vizelet biokémiai paramétereinek élettani szerepe és diagnosztikai értéke). Tankönyv 4. kiadás. Blagovescsenszk, 2010.
4. Borodina G.P., Borodin E.A. Biokémiai diagnózis (a vér és a vizelet biokémiai paramétereinek élettani szerepe és diagnosztikai értéke). Elektronikus tankönyv. Blagovescsenszk, 2007.
5. Feladatok a tanulók bioorganikus kémiával kapcsolatos tudásának számítógépes teszteléséhez (Összeállította: Borodin E.A., Doroshenko G.K., Egorshina E.V.) Blagoveshchensk, 2003.
6. Bioszerves kémia tesztfeladatok az orvosi egyetemek orvosi karának hallgatói számára a bioszerves kémia vizsgához. Eszközkészlet. (Összeállította: Borodin E.A., Doroshenko G.K.). Blagovescsenszk, 2002.
7. Bioszerves kémia tesztfeladatok bioszerves kémia gyakorlati órákhoz az Általános Orvostudományi Kar hallgatói számára. Eszközkészlet. (Összeállította: Borodin E.A., Doroshenko G.K.). Blagovescsenszk, 2002.
8. Vitaminok. Eszközkészlet. (Összeállította: Egorshina E.V.). Blagovescsenszk, 2001.
8.5 Fegyelem biztosítása felszerelésekkel és oktatási anyagokkal 1 Vegyi üvegáru:
Üvegáru:
1,1 kémiai kémcső 5000 Kémiai kísérletek és elemzések gyakorlati órákon, UIRS, 1,2 centrifugacső 2000 Kémiai kísérletek és elemzések gyakorlati órákon, UIRS, 1,3 üvegpálca 100 Kémiai kísérletek és elemzések gyakorlati órákon, UIRS, 1.4. különböző térfogatú lombikok (200 kémiai kísérletekhez és elemzésekhez gyakorlati órákon, UIRS, 1,5 nagy térfogatú lombik - 0,5-2,0 30 Kémiai kísérletek és elemzések gyakorlati órákon, UIRS, 1,6 kémiai főzőpohár különféle 120 Kémiai kísérletek és elemzések gyakorlati órákon, UIRS, 1,7 nagyméretű vegyi főzőpohár 50 Kémiai kísérletek és elemzések gyakorlati órákon, UIRS, dolgozók felkészítése 1,8 különböző méretű lombik 2000 Kémiai kísérletek és elemzések gyakorlati órákon, UIRS, 1,9 szűrőtölcsér 200 Kémiai kísérletek és elemzések gyakorlati órákon, UIRS 1.10 üvegáru Kémiai kísérletek és elemzések gyakorlati órákon, CIRS, kromatográfia stb.).
1.11 alkohollámpa 30 Kémiai kísérletek és elemzések gyakorlati órákon, UIRS, Porcelán edények 1.12 pohár különböző térfogatok (0,2-30 Reagensek készítése gyakorlati órákhoz 1,13 mozsár és mozsártörő Reagensek készítése gyakorlati órákhoz, kémiai kísérletekhez és 1,15 csésze párologtatáshoz 20 Kémiai kísérletek és elemzések gyakorlati órákhoz, UIRS, Mérőüveg:
1,16 különböző mérőlombik 100 Reagensek készítése gyakorlati órákhoz, kémiai kísérletekhez 1,17 különböző mérőhengerek 40 Reagensek előkészítése gyakorlati órákhoz, kémiai kísérletek 1,18 különböző térfogatú főzőpohár 30 Reagensek készítése kémiai mérésekhez, kémiai kísérletekhez Kémiai kísérletek és elemzések gyakorlati órákhoz, UIRS, mikropipetták) 1.20 mechanikai automata 15 Kémiai kísérletek és elemzések gyakorlati órákon, UIRS, 1.21 mechanikus automata 2 Kémiai kísérletek és elemzések gyakorlati órákon, UIRS, változó térfogatú adagolók NIRS 1.22 elektronikus kísérletek automata 1 és elemzések gyakorlati órákon, UIRS, 1.23 AC mikrofecskendők 5 Kémiai kísérletek és elemzések gyakorlati órákon, UIRS, 2 Technikai felszerelés:
2.1 kémcső állvány 100 Kémiai kísérletek és elemzések gyakorlati órákon, UIRS, 2.2 pipetta állvány 15 Kémiai kísérletek és elemzések gyakorlati órákon, UIRS, 2.3 fém állványok 15 Kémiai kísérletek és elemzések gyakorlati órákon, UIRS, Fűtőberendezések:
2.4 szárítószekrények 3 Vegyi üvegáruk szárítása, vegyszerek tárolása 2,5 légtermosztát 2 Az inkubációs keverék termosztálása 2,6 víztermosztát meghatározásánál 2 Az inkubációs keverék termosztálása 2,7 elektromos tűzhely meghatározásánál 3 Reagensek előkészítése gyakorlati gyakorlatokhoz, kémiai kísérletekhez és 2,8 Hűtőszekrények fagyasztóval 5 Vegyi reagensek, oldatok és biológiai anyagok tárolása „Chinar ”, „Biryusa”, gyakorlati gyakorlatok , UIRS, NIRS „Stinol”
2.9 Tárolószekrények 8 Vegyi reagensek tárolása 2.10 Fémbiztos 1 Mérgező anyagok tárolása reagensek és etanol 3 Általános célú berendezések:
3.1 analitikai csappantyú 2 Gravimetriás analízis gyakorlati órákon, UIRS, NIRS 3.6 Ultracentrifuga 1 Az üledékképződés elemzési módszerének bemutatása gyakorlati órákon (Németország) 3.8 Mágneses keverők 2 Reagensek előkészítése gyakorlati órákhoz 3.9 Elektromos vízlepárló reagensek 3.10 Hőmérőkhöz 10 Hőmérsékletszabályozás kémiai elemzések során 3.11 Hidrométer készlet 1 Oldatok sűrűségének mérése 4 Speciális berendezések:
4.1. Elektroforézis készülék 1. Szérumfehérjék elektroforézisének módszerének bemutatása 4.2. Elektroforézis készülék 1. A szérum lipoproteinek elválasztási módszerének bemutatása 4.3. Berendezés oszlophoz A fehérjék elválasztási módszerének bemutatása a TLC4 kromatográfiás demonstrációs kromatográfiával 4. módszer a lipidek elválasztására praktikus vékony kromatográfiás rétegen. osztályok, NIRS Mérőberendezések:
Fotoelektromos koloriméterek:
4.8 „SOLAR” fotométer 1 Színes oldatok fényelnyelésének mérése 4.9 SF 16 spektrofotométer 1 Mérés oldatok fényelnyelése a látható és UV tartományban 4.10 Klinikai spektrofotométer 1 Oldatok fényelnyelésének mérése a „Schimadzu - CL–770” spektrum látható és UV tartományában spektrális meghatározási módszerekkel 4.11 Nagy hatékonyság 1 A HPLC módszer bemutatása (gyakorlati gyakorlatok, UIRS, NIRS) folyadékkromatográf "Milichrome - 4".
4.12 Polariméter 1 Az enantiomerek optikai aktivitásának kimutatása, 4.13 Refraktométer 1 demonstráció refraktometriás meghatározási módszer 4,14 pH-mérő 3 Pufferoldatok készítése, puffer bemutatása 5 Vetítő berendezés:
5.1 Multimédiás projektor és 2 Multimédiás bemutatók, fotó- és írásvetítők bemutatója: Bemutató diák előadások és gyakorlati órák alatt 5.3 „Félautomata csapágy” 5.6 Bemutató eszköz A morfológiai oktatási épülethez rendelve. Átlátszó filmek (rezsi) és szemléltető anyagok bemutatása előadásokon, UIRS és NIRS filmvetítő alatt.
6 Számítástechnika:
6.1 Tanszéki hálózat 1 Hozzáférés az INTERNET oktatási forrásaihoz (nemzeti és személyi számítógépek nemzetközi elektronikus adatbázisokkal a kémiáról, a biológiáról és az INTERNET-gyógyászathoz való hozzáférés) a tanszék oktatói és az oktatási és hallgatói 6.2 Személyi számítógépek 8 osztály nyomtatott és elektronikus tanszéki didaktikai anyagok osztálya az oktatási és módszertani munka során, 6,3 Számítógép óra 10 1 A tanulók tudásának programozott tesztelése gyakorlati órákon, teszteken és vizsgákon (aktuális, 7 Oktatási táblázat:
1. Peptid kötés.
2. A polipeptid lánc szerkezetének szabályszerűsége.
3. A fehérje molekula kötéseinek típusai.
4. Diszulfid kötés.
5. A fehérjék fajspecifikussága.
6. A fehérjék másodlagos szerkezete.
7. A fehérjék harmadlagos szerkezete.
8. Mioglobin és hemoglobin.
9. Hemoglobin és származékai.
10. Vérplazma lipoproteinek.
11. A hiperlipidémia típusai.
12. Fehérjék elektroforézise papíron.
13. A fehérje bioszintézis sémája.
14. Kollagén és tropokollagén.
15. Miozin és aktin.
16. Vitaminhiány RR (pellagra).
17. B1-vitamin hiány.
18. C-vitamin hiány.
19. A vitaminhiány.
20. D-vitamin-hiány (rachitis).
21. A prosztaglandinok a telítetlen zsírsavak fiziológiailag aktív származékai.
22. A katekalaminokból és indolaminokból képződő neuroxinok.
23. A dopamin nem enzimatikus reakcióinak termékei.
24. Neuropeptidek.
25. Többszörösen telítetlen zsírsavak.
26. Liposzómák kölcsönhatása a sejtmembránnal.
27. Szabad oxidáció (a szöveti légzéstől való eltérések).
28. Az omega 6 és omega 3 család PUFA-i.
2 Diakészletek a program különböző szakaszaihoz 8.6 Interaktív tanulási eszközök (internetes technológiák), multimédiás anyagok, Elektronikus könyvtárak és tankönyvek, fotó- és videóanyagok 1 Interaktív tanulási eszközök (internetes technológiák) 2 Multimédiás anyagok Stonik V.A. (TIBOH DSC SB RAS) „A természetes vegyületek az alap 5 Borodin E.A. (AGMA) „Emberi genom. Genomika, proteomika és a szerző előadása 6 Pivovarova E.N (Citológiai és Genetikai Intézet, az Orosz Orvostudományi Akadémia szibériai fiókja) „A génexpresszió szabályozásának szerepe A szerző bemutatása egy személyről.”
3 Elektronikus könyvtárak és tankönyvek:
2 MEDLINE. Kémia, biológia és orvostudomány elektronikus adatbázisainak CD-változata.
3 Élettudományok. Kémiai és biológia elektronikus adatbázisok CD-változata.
4 Cambridge Scientific Abstracts. Kémiai és biológia elektronikus adatbázisok CD-változata.
5 PubMed - az Országos Egészségügyi Intézet elektronikus adatbázisa http://www.ncbi.nlm.nih.gov/pubmed/ Szerves kémia. Digitális könyvtár. (Összeállította: N. F. Tyukavkina, A. I. Khvostova) - M., 2005.
Szerves és általános kémia. Gyógyszer. Előadások hallgatóknak, tanfolyam. (Elektronikus kézikönyv). M., 2005
4 videó:
3 MES TIBOKH DSC FEB RAS CD
5 Fotó és videó anyagok:Szerzői fotók és videó anyagok a fejről. osztály prof. E.A. Borodin körülbelül 1 uppsalai (Svédország), granadai (Spanyolország), japán egyetemek orvosi iskoláiról (Niigata, Osaka, Kanazawa, Hirosaki), az Orosz Orvostudományi Akadémia Orvosbiológiai Kémiai Intézetéről, Fizikai Kémiai és Kémiai Intézetről Oroszország Egészségügyi Minisztériumának TIBOKHE DSC. FEB RAS.
8.1. Példák az aktuális kontrolltesztekre (standard válaszokkal) a 4. „Savás és lúgosság szerves molekulák"
1. Válassza ki a Bronsted-Lowry savak jellemző tulajdonságait:
1. növeli a hidrogénionok koncentrációját vizes oldatokban 2. növeli a hidroxid ionok koncentrációját vizes oldatokban 3. semleges molekulák és ionok - proton donorok 4. semleges molekulák és ionok - proton akceptorok 5. nem befolyásolják a reakciót a táptalaj 2. Adja meg a szerves molekulák savasságát befolyásoló tényezőket:
1. a heteroatom elektronegativitása 2. a heteroatom polarizálhatósága 3. a gyök természete 4. disszociációs képessége 5. oldhatósága vízben 3. A felsorolt vegyületek közül válassza ki a legerősebb Bronsted-savakat:
1. alkánok 2. aminok 3. alkoholok 4. tiolok 5. karbonsavak 4. Jelölje meg a bázis tulajdonságokkal rendelkező szerves vegyületek jellemző tulajdonságait:
1. proton akceptorok 2. proton donorok 3. disszociációkor hidroxil ionokat adnak 4. nem disszociálnak 5. az alapvető tulajdonságok határozzák meg a reakcióképességet 5. Válassza ki a leggyengébb bázist a megadott vegyületek közül:
1. ammónia 2. metil-amin 3. fenil-amin 4. etil-amin 5. propil-amin 8.2 Példák az áramszabályozás szituációs feladataira (val válaszszabványok) 1. Határozza meg az vegyület szülőszerkezetét:
Megoldás. A szerves vegyület szerkezeti képletében a szülőszerkezet megválasztását az IUPAC helyettesítő nómenklatúrája számos következetesen alkalmazott szabály szabályozza (lásd Tankönyv, 1.2.1).
Minden következő szabály csak akkor kerül alkalmazásra, ha az előző nem teszi lehetővé az egyértelmű választást. Az (I) vegyület alifás és aliciklusos fragmenseket tartalmaz. Az első szabály szerint szülőstruktúraként azt a struktúrát választjuk, amellyel a szenior jellemzőcsoport közvetlenül kapcsolódik. Az (I) vegyületben jelenlévő két jellemző csoport (OH és NH) közül a hidroxilcsoport a legrégebbi. Ezért a kezdeti szerkezet ciklohexán lesz, ami ennek a vegyületnek a nevében is tükröződik - 4-amino-metil-ciklohexanol.
2. Számos biológiailag fontos vegyület és gyógyszer alapja egy kondenzált heterociklusos purin rendszer, beleértve a pirimidin és imidazol magokat. Mi magyarázza a purin fokozott oxidációval szembeni ellenállását?
Megoldás. Az aromás vegyületek nagy konjugációs energiával és termodinamikai stabilitással rendelkeznek. Az aromás tulajdonságok egyik megnyilvánulása az oxidációval szembeni ellenállás, bár „külsőleg”
az aromás vegyületek nagymértékű telítetlenséggel rendelkeznek, ami általában hajlamossá teszi őket az oxidációra. A problémafelvetésben feltett kérdés megválaszolásához meg kell állapítani, hogy a purin az aromás rendszerekhez tartozik-e.
Az aromás definíció szerint a konjugált zárt rendszer kialakulásának szükséges (de nem elégséges) feltétele, hogy a molekulában lapos ciklikus váz jelen legyen, egyetlen elektronfelhővel. A purin molekulában minden szén- és nitrogénatom sp2 hibridizációs állapotban van, ezért az összes kötés ugyanabban a síkban helyezkedik el. Emiatt a ciklusban szereplő összes atom pályája a vázsíkra merőlegesen és egymással párhuzamosan helyezkedik el, ami megteremti a kölcsönös átfedés feltételeit egyetlen zárt, delokalizált ti-elektron rendszer kialakulásával, amely az összes atomot lefedi. a ciklus (kör alakú ragozás).
Az aromásságot az -elektronok száma is meghatározza, aminek meg kell felelnie a 4/7 + 2 képletnek, ahol n az O, 1, 2, 3 stb. természetes számok sorozata (Hückel-szabály). Mindegyik szénatom és az 1., 3. és 7. pozícióban lévő piridin nitrogénatom egy p-elektronnal járul hozzá a konjugált rendszerhez, a 9. pozícióban lévő pirrol nitrogénatom pedig egy magányos elektronpárt. A konjugált purinrendszer 10 elektront tartalmaz, ami megfelel a Hückel-szabálynak n = 2-nél.
Így a purinmolekula aromás karakterű, és az oxidációval szembeni ellenállása ehhez kapcsolódik.
A heteroatomok jelenléte a purinciklusban az elektronsűrűség egyenetlen eloszlásához vezet. A piridin-nitrogénatomok elektronvonó jelleget mutatnak, és csökkentik a szénatomokon az elektronsűrűséget. Ebben a tekintetben a purin oxidációja, amelyet általában az oxidáló vegyület által az elektronok elvesztésének tekintenek, még nehezebb lesz, mint a benzol.
8.3 Tesztfeladatok teszteléshez (egy lehetőség teljes egészében válaszstandardokkal) 1. Nevezze meg az organogén elemeket:
7.Si 8.Fe 9.Cu 2.Jelölje meg azokat a funkciós csoportokat, amelyekben Pi-kötés található:
1. Karboxil 2. aminocsoport 3. hidroxil 4. oxo csoport 5. karbonil 3. Jelölje meg a vezető funkciós csoportot:
1.-C=O 2.-SO3H 3.-CII 4.-COOH 5.-OH 4. Milyen szerves vegyületek osztályába tartozik a szövetekben a glükóz anaerob lebomlása következtében képződő CH3-CHOH-COOH tejsav , tartozni vmihez?
1. Karbonsavak 2. Hidroxisavak 3. Aminosavak 4. Ketosavak 5. Nevezze meg szubsztitúciós nómenklatúrával azt az anyagot, amely a sejt fő energiahordozója és a következő szerkezettel rendelkezik:
CH2-CH-CH-CH-CH-C=O
I I III I
OH OH OH OH H
1. 2,3,4,5,6-pentahidroxihexanal 2,6-oxohexanepnentanol 1,2,3,4, 3. Glükóz 4. Hexóz 5,1,2,3,4,5-pentahidroxihexanal- 6. Jelölje meg a konjugált jellemző tulajdonságait rendszerek:1. A szigma és pi kötések elektronsűrűségének kiegyenlítése 2. Stabilitás és alacsony reaktivitás 3. Instabilitás és nagy reaktivitás 4. Váltakozó szigma és pi kötéseket tartalmaz 5. A Pi kötéseket -CH2 csoportok választják el 7. Mely vegyületekre jellemző Pi- Pi ragozás:
1. karotinok és A-vitamin 2. pirrol 3. piridin 4. porfirinek 5. benzpirén 8. Válassza ki az első típusú szubsztituenseket, amelyek orto- és para-helyzetben vannak:
1.alkil 2.- OH 3.- NH 4.- COOH 5.- SO3H 9. Milyen hatása van az -OH csoportnak az alifás alkoholokban:
1. Pozitív induktív 2. Negatív induktív 3. Pozitív mezomer 4. Negatív mezomer 5. A hatás típusa és előjele az -OH csoport helyzetétől függ 10. Válassza ki a negatív mezomer hatású gyököket 1. Halogének 2. Alkilcsoportok 3. Aminocsoport 4. Hidroxicsoport 5. Karboxilcsoport 11. Válassza ki a Bronsted-Lowry savak jellemző tulajdonságait:
1. növeli a hidrogénionok koncentrációját vizes oldatokban 2. növeli a hidroxid ionok koncentrációját vizes oldatokban 3. semleges molekulák és ionok - proton donorok 4. semleges molekulák és ionok - proton akceptorok 5. nem befolyásolják a reakciót a táptalaj 12. Adja meg a szerves molekulák savasságát befolyásoló tényezőket:
1. a heteroatom elektronegativitása 2. a heteroatom polarizálhatósága 3. a gyök természete 4. disszociációs képessége 5. vízben való oldhatósága 13. A felsorolt vegyületek közül válassza ki a legerősebb Bronsted-savakat:
1. alkánok 2. aminok 3. alkoholok 4. tiolok 5. karbonsavak 14. Jelölje meg a bázis tulajdonságokkal rendelkező szerves vegyületek jellemzőit!
1. proton akceptorok 2. proton donorok 3. disszociációkor hidroxil ionokat adnak 4. nem disszociálnak 5. az alapvető tulajdonságok határozzák meg a reakcióképességet 15. Válassza ki a leggyengébb bázist a megadott vegyületek közül:
1. ammónia 2. metil-amin 3. fenil-amin 4. etil-amin 5. propil-amin 16. Milyen jellemzők alapján osztályozzák a szerves vegyületek reakcióit:
1. A kémiai kötés felszakadásának mechanizmusa 2. A reakció végeredménye 3. A teljes folyamat sebességét meghatározó szakaszban részt vevő molekulák száma 4. A kötést megtámadó reagens jellege 17. Válassza ki az aktív Az oxigén formái:
1. szingulett oxigén 2. peroxid diradikális -O-O-szuperoxid ion 4. hidroxil gyök 5. triplett molekuláris oxigén 18. Válassza ki az elektrofil reagensek jellemző tulajdonságait:
1.részleges vagy teljes pozitív töltést hordozó részecskék 2.kovalens kötés homolitikus hasításával jönnek létre 3.páratlan elektront hordozó részecskék 4.részleges vagy teljes negatív töltést hordozó részecskék 5.heterolitikus hasítással jönnek létre kovalens kötés 19. Válassza ki azokat a vegyületeket, amelyekre jellemző reakció az elektrofil szubsztitúció:
1. alkének 2. arének 3. alkadiének 4. aromás heterociklusok 5. alkánok 20. Mutassa be a szabad gyökös oxidációs reakciók biológiai szerepét!
1. a sejtek fagocita aktivitása 2. a sejtmembránok elpusztításának univerzális mechanizmusa 3. a sejtszerkezetek önmegújulása 4. számos kóros folyamat kialakulásában meghatározó szerepet játszik 21. Válassza ki, hogy a szerves vegyületek mely osztályaira jellemzőek a nukleofil szubsztitúciós reakciók :
1. alkoholok 2. aminok 3. szénhidrogének halogén származékai 4. tiolok 5. aldehidek 22. Milyen sorrendben csökken a szubsztrátok reakciókészsége a nukleofil szubsztitúciós reakciókban?
1. szénhidrogének halogén származékai, amin alkoholok 2. amin alkoholok, szénhidrogének halogén származékai 3. amin alkoholok, szénhidrogének halogén származékai 4. szénhidrogének halogén származékai, amin alkoholok 23. Válasszon többértékű alkoholokat a felsorolt vegyületek közül:
1. etanol 2. etilénglikol 3. glicerin 4. xilit 5. szorbit 24. Válassza ki, mi jellemző erre a reakcióra:
CH3-CH2OH --- CH2=CH2 + H2O 1. eliminációs reakció 2. intramolekuláris dehidratációs reakció 3. ásványi savak jelenlétében megy végbe hevítéskor 4. normál körülmények között megy végbe 5. intermolekuláris dehidratációs reakció 25. Milyen tulajdonságok jelennek meg, ha egy szerves az anyag bekerül egy molekulába klór anyagok:
1. narkotikus tulajdonságok 2. könnyezés (szakadás) 3. antiszeptikus tulajdonságok 26. Válassza ki az SP2-hibridizált szénatomra jellemző reakciókat oxovegyületekben:
1. nukleofil addíció 2. nukleofil szubsztitúció 3. elektrofil addíció 4. homolitikus reakciók 5. heterolitikus reakciók 27. Milyen sorrendben csökken a karbonilvegyületek nukleofil támadásának könnyedsége?
1. aldehidek ketonok anhidridek észterek karbonsavak amidjai 2. ketonok aldehidek anhidridek észterek karbonsavak amidjai 3. anhidridek aldehidek ketonok észterek karbonsavak amidjai 28. Határozza meg, mi jellemző erre a reakcióra!
1.kvalitatív reakció aldehidekre 2.aldehid redukálószer, ezüst-oxid (I) oxidálószer 3.aldehid oxidálószer, ezüst-oxid (I) redukálószer 4.redox reakció 5.lúgban játszódik le közeg 6.ketonokra jellemző 29 .Melyik karbonilvegyületek dekarboxileződnek biogén aminokká?
1. karbonsavak 2. aminosavak 3. oxosavak 4. hidroxisavak 5. benzoesav 30. Hogyan változnak a savtulajdonságok a karbonsavak homológ sorozatában?
1. növeli 2. csökkenti 3. nem változik 31. A javasolt vegyületosztályok közül melyik heterofunkcionális:
1. hidroxisavak 2. oxosavak 3. aminoalkoholok 4. aminosavak 5. dikarbonsavak 32. hidroxisavak:
1. citromsav 2. vajsav 3. acetoecetsav 4. piroszőlő 5. almasav 33. Válasszon gyógyszereket - szalicilsav származékokat:
1. paracetamol 2. fenacetin 3. szulfonamidok 4. aszpirin 5. PAS 34. Válogatott gyógyszerek - p-aminofenol származékok:
1. paracetamol 2. fenacetin 3. szulfonamidok 4. aszpirin 5. PAS 35. Válogatott gyógyszerek - szulfanilsav származékok:
1. paracetamol 2. fenacetin 3. szulfonamidok 4. aszpirin 5. PASK 36. Válassza ki A. M. Butlerov elméletének főbb rendelkezéseit:
1. a szénatomok egyszerű és többszörös kötéssel kapcsolódnak egymáshoz 2. a szerves vegyületekben a szén négyértékű 3. a funkciós csoport határozza meg az anyag tulajdonságait 4. a szénatomok nyitott és zárt ciklusokat alkotnak 5. szerves vegyületekben a szén redukált formában van 37. Melyek a térbeli izomerek:
1. láncok 2. többszörös kötések helyzete 3. funkciós csoportok 4. szerkezeti 5. konfigurációs 38. Válassza ki, mi jellemző a „konformáció” fogalmára!
1. a forgás lehetősége egy vagy több szigma kötés körül 2. a konformerek izomerek 3. a kötések sorrendjének változása 4. a szubsztituensek térbeli elrendezésének megváltozása 5. az elektronszerkezet változása 39. Válassza ki a hasonlóságot enantiomerek és diasztereomerek:
1. azonos fizikai-kémiai tulajdonságokkal rendelkeznek 2. képesek elforgatni a fény polarizációs síkját 3. nem képesek elforgatni a fény polarizációs síkját 4. sztereoizomerek 5. kiralitási centrum jelenléte jellemzi 40. Válassza ki a konfigurációs és a konformációs izoméria hasonlóságát:
1. Az izomerizmus az atomok és atomcsoportok térbeli különböző helyzeteihez kapcsolódik. 2. Az izomerizmus az atomok vagy atomcsoportok szigma kötés körüli forgásából adódik. 4. Az izomerizmus a szubsztituensek pi kötéssíkhoz viszonyított eltérő elrendezéséből adódik.
41. Nevezze meg a biológiailag fontos heterociklusokat alkotó heteroatomokat:
1.nitrogén 2.foszfor 3.kén 4.szén 5.oxigén 42.Jelölje meg a porfirinek részét képező 5 tagú heterociklust:
1.pirrolidin 2.imidazol 3.pirrol 4.pirazol 5.furán 43.Melyik egy heteroatomos heterociklus része a nikotinsavnak:
1. purin 2. pirazol 3. pirrol 4. piridin 5. pirimidin 44. Nevezze meg a purin oxidáció végtermékét a szervezetben:
1. hipoxantin 2. xantin 3. húgysav 45. Adja meg az ópium alkaloidokat:
1. sztrichnin 2. papaverin 4. morfium 5. rezerpin 6. kinin 6. Milyen oxidációs reakciók jellemzőek az emberi szervezetre:
1.dehidrogénezés 2.oxigén hozzáadása 3.elektronok adományozása 4.halogének hozzáadása 5.kölcsönhatás kálium-permanganáttal, salétromsavval és perklórsavval 47.Mi határozza meg a szénatom oxidációs fokát szerves vegyületekben:
1. a hidrogénnél elektronegatívabb elemek atomjaival létesített kötéseinek száma 2. oxigénatomokkal kötött kötéseinek száma 3. hidrogénatomokkal kötött kötéseinek száma 48. Milyen vegyületek keletkeznek az elsődleges szénatom oxidációja során?
1. primer alkohol 2. szekunder alkohol 3. aldehid 4. keton 5. karbonsav 49. Határozza meg, mi jellemző az oxidáz reakciókra!
1. az oxigén vízzé redukálódik 2. az oxigén benne van az oxidált molekula összetételében 3. az oxigén a szubsztrátról levált hidrogén oxidációjához megy 4. a reakciók energetikai értékűek 5. a reakciók képlékeny értékűek 50. Melyik a javasolt szubsztrátok közül könnyebben oxidálódik a sejtben és miért?
1. glükóz 2. zsírsav 3. részlegesen oxidált szénatomokat tartalmaz 4. teljesen hidrogénezett szénatomokat tartalmaz 51. Aldózok kiválasztása:
1. glükóz 2. ribóz 3. fruktóz 4. galaktóz 5. dezoxiribóz 52. Válassza ki a szénhidrátok tartalék formáit egy élő szervezetben:
1. rost 2. keményítő 3. glikogén 4. hialurinsav 5. szacharóz 53. Válassza ki a természetben leggyakrabban előforduló monoszacharidokat:
1. triózok 2. tetrózok 3. pentózok 4. hexózok 5. heptózok 54. Válasszon aminocukrokat:
1. béta-ribóz 2. glükózamin 3. galaktózamin 4. acetil-galaktózamin 5. dezoxiribóz 55. Válassza ki a monoszacharid oxidáció termékeit:
1. glükóz-6-foszfát 2. glikon (aldon) savak 3. glikuron (uron) savak 4. glikozidok 5. észterek 56. Disacharidok kiválasztása:
1. maláta 2. rost 3. glikogén 4. szacharóz 5. laktóz 57. Válasszon homopoliszacharidokat:
1. keményítő 2. cellulóz 3. glikogén 4. dextrán 5. laktóz 58. Válassza ki, mely monoszacharidok képződnek a laktóz hidrolízise során:
1.béta-D-galaktóz 2.alfa-D-glükóz 3.alfa-D-fruktóz 4.alfa-D-galaktóz 5.alfa-D-dezoxiribóz 59. Válassza ki, mi jellemző a cellulózra:
1. lineáris, növényi poliszacharid 2. szerkezeti egysége a béta-D-glükóz 3. szükséges a normál táplálkozáshoz, ballaszt anyag 4. emberben a fő szénhidrát 5. nem bomlik le a gyomor-bél traktusban 60. Válassza ki a szénhidrát származékokat amik a muramint alkotják:
1.N-acetil-glükózamin 2.N-acetilmuraminsav 3.glükózamin 4.glükuronsav 5.ribulóz-5-foszfát 61.Válassza ki a megfelelő állításokat az alábbiak közül: Az aminosavak...
1. a molekulában amino- és hidroxilcsoportokat egyaránt tartalmazó vegyületek 2. hidroxil- és karboxilcsoportokat tartalmazó vegyületek 3. karbonsavak származékai, amelyek gyökében a hidrogént aminocsoport helyettesíti 4. oxo- és karboxilcsoportokat tartalmazó vegyületek a molekulában 5. hidroxi- és aldehidcsoportokat tartalmazó vegyületek 62. Hogyan osztályozzák az aminosavakat?
1. a gyök kémiai természete szerint 2. fiziko-kémiai tulajdonságai szerint 3. funkciós csoportok száma szerint 4. telítetlenségi foka szerint 5. további funkciós csoportok jellege szerint 63. Válasszon ki egy aromás aminosavat:
1. glicin 2. szerin 3. glutamin 4. fenilalanin 5. metionin 64. Válasszon ki egy savas tulajdonságokat mutató aminosavat:
1. leucin 2. triptofán 3. glicin 4. glutaminsav 5. alanin 65. Válasszon ki egy bázikus aminosavat:
1. szerin 2. lizin 3. alanin 4. glutamin 5. triptofán 66. Purin nitrogéntartalmú bázisok kiválasztása:
1. timin 2. adenin 3. guanin 4. uracil 5. citozin 67. Pirimidin nitrogéntartalmú bázisok kiválasztása:
1.uracil 2.timin 3.citozin 4.adenin 5.guanin 68.Válassza ki a nukleozid összetevőit:
1.purin nitrogénbázisok 2.pirimidin nitrogénbázisok 3.ribóz 4.dezoxiribóz 5.foszforsav 69.Jelölje meg a nukleotidok szerkezeti összetevőit:
1. purin nitrogén bázisok 2. pirimidin nitrogén bázisok 3. ribóz 4. dezoxiribóz 5. foszforsav 70. Mutassa be a DNS megkülönböztető jellemzőit:
1. egy polinukleotid lánc alkotja 2. két polinukleotid lánc alkotja 3. ribózt tartalmaz 4. dezoxiribózt tartalmaz 5. uracilt tartalmaz 6. timint tartalmaz 71. Elszappanosítható lipidek kiválasztása:
1. semleges zsírok 2. triacilglicerinek 3. foszfolipidek 4. szfingomielinek 5. szteroidok 72. Válasszon telítetlen zsírsavakat:
1. palmitinsav 2. sztearinsav 3. olajsav 4. linolsav 5. arachidonsav 73. Adja meg a semleges zsírok jellemző összetételét:
1.mericil-alkohol + palmitinsav 2.glicerin + vajsav 3.szfingozin + foszforsav 4.glicerin + magasabb szénatomszámú karbonsav + foszforsav 5.glicerin + magasabb karbonsavak 74. Válassza ki, hogy a foszfolipidek milyen funkciót töltenek be az emberi szervezetben:
1. szabályozó 2. védő 3. szerkezeti 4. energetikai 75. Glikolipidek kiválasztása:
1.foszfatidilkolin 2.cerebrozidok 3.szfingomielinek 4.szulfatidok 5.gangliozidok
VÁLASZOK TESZT FELADATOKRA
8.4 A teljesítéshez szükséges gyakorlati készségek és feladatok listája (teljes terjedelmében) 1. Képes a szerves vegyületek szénváz szerkezete szerinti osztályozására és 2. Képletek név és név szerinti összeállításának képessége a biológiailag fontos anyagok jellemző képviselői, ill. gyógyszerek szerkezeti képlet szerint.3. Képes a molekulákban lévő funkcionális csoportok, savas és bázikus centrumok, konjugált és aromás fragmentumok izolálására a kémiai viselkedés meghatározásához 4. Képes a szerves kémiai átalakulások irányának és eredményének előrejelzésére 5. Az önálló munkavégzés készségeinek birtoklása oktatással tudományos és referencia irodalom; végezzen keresést és vonjon le általános következtetéseket.
6. Vegyi üvegáru kezelésében jártasság birtokában.
7. A vegyi laboratóriumban végzett biztonságos munkavégzés ismerete és a maró, mérgező, erősen illékony szerves vegyületek kezelésének ismerete, égővel, alkohollámpával, elektromos fűtőberendezéssel végzett munka.
1. Bioszerves kémia tantárgy és feladatai. Következmények az orvosképzésben.
2. A szerves vegyületek elemi összetétele, mint a biológiai folyamatoknak való megfelelés oka.
3. Szerves vegyületek osztályozása. Osztályok, általános képletek, funkciós csoportok, egyéni képviselők.
4. A szerves vegyületek nómenklatúrája. Triviális nevek. Helyettesítő IUPAC-nómenklatúra.
5. Főbb funkciós csoportok. Szülői struktúra. képviselők. Csoportok, helyettesek vezetősége. Funkciós csoportok és szubsztituensek nevei előtagként és végződésként.
6. A szerves vegyületek szerkezetének elméleti alapjai. A. M. Butlerov elmélete.
Szerkezeti képletek. Strukturális izoméria. Lánc- és helyzetizomerek.
7. Szerves vegyületek térszerkezete. Sztereokémiai képletek.
Molekuláris modellek. A sztereokémiában a legfontosabb fogalmak a szerves molekulák konfigurációja és konformációja.
8. Nyitott láncok konformációi - elhomályosult, gátolt, ferde. Különböző konformációk energiája és reakciókészsége.
9. Ciklusok konformációi ciklohexán példáján (szék és fürdő). Axiális és ekvatoriális kapcsolatok.
10. Az atomok kölcsönös hatása szerves vegyületek molekuláiban. Okai, megnyilvánulási típusai. Molekulák reakcióképességére gyakorolt hatás.
11.Párosítás. Konjugált rendszerek, konjugált kapcsolatok. Pi-pi konjugáció diénekben. Konjugációs energia. Kapcsolt rendszerek stabilitása (A-vitamin).
12. Párosítás az arénákban (pi-pi párosítás). Aromás. Hückel szabálya. Benzol, naftalin, fenantrén. A benzolgyűrű reakcióképessége.
13. Konjugáció heterociklusokban (p-pi és pi-pi konjugáció pirrol és piridin példájával).
Heterociklusok stabilitása - biológiai jelentősége a tetrapirrol vegyületek példáján.
14.Kötvények polarizációja. Okoz. Polarizáció alkoholokban, fenolokban, karbonilvegyületekben, tiolokban. Molekulák reakciókészségére gyakorolt hatás.\ 15. Elektronikus hatások. Induktív hatás a szigma kötéseket tartalmazó molekulákban. Az induktív hatás jele.
16. Mezomer hatás nyitott láncokban konjugált pi-kötésekkel, 1,3-butadién példájával.
17.Mezomer hatás aromás vegyületekben.
18.Elektronadó és elektronszívó szubsztituensek.
19. 1. és 2. fajta képviselők. Az orientáció szabálya a benzolgyűrűben.
20. Szerves vegyületek savassága és lúgossága. Brendstet-Lowry savak és bázisok.
A sav-bázis párok konjugált savak és bázisok. A Ka és a pKa a szerves vegyületek savasságának mennyiségi jellemzői. A savasság jelentősége a szerves molekulák funkcionális aktivitásában.
21.A szerves vegyületek különböző osztályainak savassága. A szerves vegyületek savasságát meghatározó tényezők a hidrogénhez kötődő nemfém atom elektronegativitása, a nemfém atom polarizálhatósága, a nemfém atomhoz kötődő gyök természete.
22.Szerves alapok. Aminok. Az alaposság oka. A gyökök hatása az alifás és aromás aminok bázikusságára.
23. Szerves vegyületek reakcióinak osztályozása mechanizmusuk szerint. A homolitikus és heterolitikus reakciók fogalmai.
24. Gyök helyettesítési reakciók alkánokban. Szabad gyökök oxidációja élő szervezetekben. Reaktív oxigén fajok.
25. Elektrofil addíció alkénekben. Pi-komplexek, karbokationok képződése. Hidratációs, hidrogénezési reakciók.
26.Elektrofil szubsztitúció az aromás gyűrűben. Köztes szigma komplexek kialakulása. Benzol brómozási reakció.
27. Nukleofil szubsztitúció alkoholokban. Dehidratációs reakciók, primer és szekunder alkoholok oxidációja, észterek képződése.
28. Karbonilvegyületek nukleofil addíciója. Az aldehidek biológiailag fontos reakciói: oxidáció, alkoholokkal való kölcsönhatás során félacetálok képződése.
29.Nukleofil szubsztitúció karbonsavakban. A karbonsavak biológiailag fontos reakciói.
30. Szerves vegyületek oxidációja, biológiai jelentősége. A szén oxidációs foka a szerves molekulákban. A szerves vegyületek különböző osztályainak oxidálhatósága.
31.Energetikai oxidáció. Oxidáz reakciók.
32.Nem energetikai oxidáció. Oxigenáz reakciók.
33. A szabad gyökök oxidációjának szerepe a fagocita sejtek baktericid hatásában.
34. Szerves vegyületek helyreállítása. Biológiai jelentősége.
35.Többfunkciós vegyületek. Többértékű alkoholok - etilénglikol, glicerin, xilit, szorbit, inozit. Biológiai jelentősége. A glicerin biológiailag fontos reakciói az oxidáció és az észterek képződése.
36.Kétbázisú dikarbonsavak: oxálsav, malonsav, borostyánkősav, glutársav.
A borostyánkősav fumársavvá történő átalakítása a biológiai dehidrogénezés egyik példája.
37. Aminok. Osztályozás:
A gyök természete szerint (alifás és aromás); -a gyökök száma szerint (primer, szekunder, tercier, kvaterner ammóniumbázisok); - az aminocsoportok (mono- és diaminok-) számával. Diaminok: putreszcin és cadaverin.
38. Heterofunkciós vegyületek. Meghatározás. Példák. A kémiai tulajdonságok megnyilvánulásának jellemzői.
39. Aminoalkoholok: etanol-amin, kolin, acetilkolin. Biológiai jelentősége.
40.Hidroxisavak. Meghatározás. Általános képlet. Osztályozás. Elnevezéstan. Izomerizmus.
A monokarbonsav-hidroxisavak képviselői: tejsav, béta-hidroxi-vajsav, gamma-xivajsav;
dikarbonát: alma, bor; trikarbonsav: citrom; aromás: szalicil.
41. A hidroxisavak kémiai tulajdonságai: karboxil, hidroxilcsoport szerint, alfa-, béta- és gamma-izomerek dehidratációs reakciói, reakciótermékek (laktidok, telítetlen savak, laktonok) különbségei.
42.Sztereoizoméria. Enantiomerek és diasztereomerek. A szerves vegyületek molekuláinak kiralitása, mint az optikai izoméria oka.
43. Enantiomerek egy kiralitási centrummal (tejsav). Az enantiomerek abszolút és relatív konfigurációja. Oxisav kulcs. D és L glicerinaldehid. D és L izomerek.
Versenytársak.
44. Több kiralitási centrummal rendelkező enantiomerek. Borkő- és mezoborkősav.
45. A sztereoizomerek sztereoizomériája és biológiai aktivitása.
46. Cisz- és transz-izoméria a fumársav és a maleinsav példáján.
47.Oxosavak. Meghatározás. Biológiailag fontos képviselői: piroszőlősav, acetoecetsav, oxálecetsav. A ketoenol tautoméria a piroszőlősav példájával.
48. Aminosavak. Meghatározás. Általános képlet. Az aminocsoport helyzetének izomerjei (alfa, béta, gamma). Az alfa-aminosavak biológiai jelentősége. A béta-, gamma- és egyéb izomerek (béta-aminopropionos, gamma-aminovajsav, epszilonaminokapronsav) képviselői. A gamma-izomerek dehidratációs reakciója ciklikus laktonok képződésével.
49. Heterofunkciós benzolszármazékok, mint gyógyszerek alapja. A p-aminobenzoesav származékai - PABA (folsav, anesztezin). A PABA antagonisták szulfanilsav-származékok (szulfonamidok – streptocid).
50. Heterofunkcionális benzolszármazékok - gyógyszerek. Raminofenol származékok (paracetamol), szalicilsav származékok (acetilszalicilsav). Raminoszalicilsav - PAS.
51.Biológiailag fontos heterociklusok. Meghatározás. Osztályozás. A szerkezet és a tulajdonságok jellemzői: konjugáció, aromás, stabilitás, reakciókészség. Biológiai jelentősége.
52. Egy heteroatomos öttagú heterociklusok és származékaik. Pirrol (porfin, porfirinek, hem), furán (gyógyszerek), tiofén (biotin).
53. Két heteroatomos öttagú heterociklusok és származékaik. Pirazol (5-oxo-származékok), imidazol (hisztidin), tiazol (B1-vitamin-tiamin).
54. Hattagú, egy heteroatomos heterociklusok és származékaik. Piridin (nikotinsav - részvétel a redox reakciókban, B6-vitamin-piridoxál), kinolin (5-NOK), izokinolin (alkaloidok).
55. Hattagú heterociklusok két heteroatommal. Pirimidin (citozin, uracil, timin).
56.Fundált heterociklusok. Purin (adenin, guanin). Purin oxidációs termékek hipoxantin, xantin, húgysav).
57. Alkaloidok. Definíció és általános jellemzők. A nikotin és a koffein szerkezete.
58. Szénhidrátok. Meghatározás. Osztályozás. A szénhidrátok funkciói az élő szervezetekben.
59. Monocukrok. Meghatározás. Osztályozás. képviselői.
60.Pentózok. Képviselői a ribóz és a dezoxiribóz. Struktúra, nyílt és ciklikus képletek. Biológiai jelentősége.
61.Hexózok. Aldózok és ketózok. képviselői.
62. A monoszacharidok nyílt képletei. Sztereokémiai konfiguráció meghatározása. A monoszacharidok konfigurációjának biológiai jelentősége.
63. Monoszacharidok ciklikus formáinak kialakulása. Glikozid-hidroxil. Alfa és béta anomerek. Haworth képletei.
64. Monoszacharidok származékai. Foszfor-észterek, glikon- és glikuronsavak, aminocukrok és acetilszármazékaik.
65. Maltóz. Összetétel, szerkezet, hidrolízis és jelentősége.
66.Laktóz. Szinonima. Összetétel, szerkezet, hidrolízis és jelentősége.
67. Szacharóz. Szinonimák. Összetétel, szerkezet, hidrolízis és jelentősége.
68. Homopoliszacharidok. képviselői. Keményítő, szerkezet, tulajdonságok, hidrolízis termékei, jelentősége.
69.Glikogén. Felépítése, szerepe az állati szervezetben.
70. Rost. Felépítése, szerepe a növényekben, jelentősége az ember számára.
72. Heteropoliszacharidok. Szinonimák. Funkciók. képviselői. Szerkezeti jellemzők: dimer egységek, összetétel. 1,3- és 1,4-glikozidos kötések.
73.Hialuronsav. Összetétel, szerkezet, tulajdonságok, jelentősége a szervezetben.
74. Kondroitin-szulfát. Összetétel, szerkezet, jelentősége a szervezetben.
75.Muramin. Összetétel, jelentés.
76. Alfa aminosavak. Meghatározás. Általános képlet. Elnevezéstan. Osztályozás. Egyéni képviselők. Sztereoizoméria.
77. Az alfa-aminosavak kémiai tulajdonságai. Amfoteritás, dekarboxilezési reakciók, dezaminálás, hidroxilezés a gyökben, peptidkötés kialakulása.
78.Peptidok. Egyedi peptidek. Biológiai szerep.
79. Mókusok. A fehérjék funkciói. A szerkezet szintjei.
80. Nukleinsavak nitrogénbázisai - purinok és pirimidinek. Módosított nitrogéntartalmú bázisok - antimetabolitok (fluorouracil, merkaptopurin).
81.Nukleozidok. Nukleozid antibiotikumok. Nukleotidok. A nukleinsavak és a szabad nukleotidok összetételében lévő mononukleotidok koenzimek.
82. Nukleinsavak. DNS és RNS. Biológiai jelentősége. Foszfodiészter kötések kialakulása a mononukleotidok között. A nukleinsav szerkezetének szintjei.
83. Lipidek. Meghatározás. Biológiai szerep. Osztályozás.
84. Magasabb karbonsavak - telített (palmitinsav, sztearinsav) és telítetlen (olajsav, linolsav, linolén és arachidonsav).
85. Semleges zsírok - acilglicerinek. Struktúra, jelentés. Állati és növényi zsírok.
Zsírok hidrolízise - termékek, jelentése. Növényi olajok, mesterséges zsírok hidrogénezése.
86. Glicerofoszfolipidek. Szerkezete: foszfatidsav és nitrogéntartalmú bázisok.
Foszfatidilkolin.
87. Szfingolipidek. Szerkezet. Szfingozin. Szfingomielin.
88. Szteroidok. Koleszterin - szerkezete, jelentése, származékai: epesavak és szteroid hormonok.
89. Terpének és terpenoidok. Szerkezete és biológiai jelentősége. képviselői.
90.Zsírban oldódó vitaminok. Általános jellemzők.
91. Érzéstelenítés. Dietil-éter. Kloroform. Jelentése.
92. Anyagcsere-folyamatokat serkentő gyógyszerek.
93. Szulfonamidok szerkezete, jelentősége. Fehér streptocid.
94. Antibiotikumok.
95. Gyulladáscsökkentő és lázcsillapító szerek Paracetamol. Szerkezet. Jelentése.
96. Antioxidánsok. Jellegzetes. Jelentése.
96. Tiolok. Ellenszerek.
97. Véralvadásgátlók. Jellegzetes. Jelentése.
98. Barbiturátok. Jellegzetes.
99. Fájdalomcsillapítók. Jelentése. Példák. Acetilszalicilsav (aszpirin).
100. Antiszeptikumok. Jelentése. Példák. Furacilin. Jellegzetes. Jelentése.
101. Vírusellenes szerek.
102. Vízhajtók.
103. Parenterális táplálás eszközei.
104. PABC, PASK. Szerkezet. Jellegzetes. Jelentése.
105. Jodoform. Xeroform.Jelentés.
106. Poligljukin. Jellegzetes. Érték 107. Formalin. Jellegzetes. Jelentése.
108. Xilit, szorbit. Struktúra, jelentés.
109. Rezorcin. Struktúra, jelentés.
110. Atropin. Jelentése.
111. Koffein. Szerkezet. Érték 113. Furacilin. Furazolidon. Jellemző.Érték.
114. GABA, GHB, borostyánkősav.. Szerkezete. Jelentése.
115. Nikotinsav. Struktúra, jelentés
| évben a Szaha Köztársaság (Jakutia) Stratégiai Tanulmányok Központja szervezésében nemzetközi részvétellel szemináriumot tartottak A Szaha Köztársaság (Jakutia) munkaerő-piaci szabályozási mechanizmusainak javítása címmel. A szemináriumon vezető külföldi tudományos intézmények, az Orosz Föderáció, a Távol-Kelet Szövetségi..." képviselői vettek részt. „Novoszibirszki Állami Vízi Közlekedési Akadémia Szakági kód: F.02, F.03 Anyagtudomány. Szerkezeti anyagok technológiája Szakterületek munkaprogramja: 180400 Ipari berendezések és technológiai komplexumok elektromos meghajtása és automatizálása és 240600 Hajóvillamos berendezések és automatizálás üzemeltetése Novoszibirszk 2001 Munkaprogramot összeállított: egyetemi docens S.V. Gorelov az állami felsőoktatási színvonal alapján..." „Az I. M. nevéről elnevezett OROSZ ÁLLAMI OLAJ- ÉS GÁZEGYETEM. Gubkina Tudományos rektorhelyettes hagyta jóvá prof. A.V. Muradov 2014. március 31. A felvételi vizsga PROGRAMJA 2014.06.15. - Gépészmérnöki képzés az I.M. után elnevezett Orosz Állami Olaj- és Gázipari Egyetem végzős iskolájára jelentkezők számára. Gubkin a 2014/2015-ös tanévben. évfolyam Moszkva 2014 A 06/15/01 Gépészmérnöki irány felvételi vizsgaprogramja a tudományos szakterületek útlevelei által meghatározott követelmények alapján készült (04/02/05,..." „5A melléklet: A Mentális Fejlődés Pszichológiája szakterület munkaprogramja SZÖVETSÉGI ÁLLAMI KÖLTSÉGVETÉSI SZAKMAI FELSŐOKTATÁSI INTÉZMÉNY PJATIGORSZKI ÁLLAMI NYELVÉSZETI EGYETEM Tudományos munkáért és szellemi fejlődésért felelős rektorhelyettese jóváhagyta. Zavrumov _2012 Posztgraduális szakképzés 19.00.07 Pedagógiai pszichológia tudományág: 19.00.00 Pszichológiai tudományok Tanszék...” „A Kabardino-Balkaria Állami Középfokú Szakképzési Intézmény Oktatási és Tudományos Minisztériuma Kabardino-Balkarian Automobile and Highway College Jóváhagyta: az Állami Szakközépfokú Oktatási Intézmény igazgatója KBADK M.A. Abregov 2013 Képzési program szakképzett munkásoknak, szakmánként dolgozóknak 190631.01.01 Autószerelő Szakképesítés Autójavító szerelő. Gépjárművezető, benzinkútkezelő képzési forma - nappali tagozatos Nalcsik, 2013 TARTALOM 1. JELLEMZŐK..." „fejti ki az ischaemiás szívbetegség matematikai modelljének lényegét, amely a szervek vérellátási mechanizmusának hagyományos nézetén alapul, és amelyet az „Orvostudományi Központ” vegyesvállalatban (Novgorod) dolgoztak ki. A statisztikák szerint jelenleg a szívkoszorúér-betegség (CHD) az első helyen áll az előfordulásban..." „AZ OROSZ FÖDERÁCIÓS KÖZLEKEDÉSI MINISZTÉRIUMA VASÚTI KÖZLEKEDÉSI SZÖVETSÉGI ÜGYNÖKSÉG szövetségi állam költségvetési felsőoktatási intézménye IRKUTSK ÁLLAMI KÖZLEKEDÉSI EGYETEM IRGUPS (IrIIT) AZ EMFA dékánja, A. Pykhalov. 2011. GYÁRTÁSI GYAKORLATI MUNKAPROGRAM C5. P Ipari gyakorlat, 3. évf. Szakterület 190300.65 Vasúti gördülőállomány Szakirány PSG.2 Autók Diplomás képesítések..." „AZ RF OKTATÁSI ÉS TUDOMÁNYOS MINISZTÉRIUMA Szövetségi Állami Költségvetési Szakmai Felsőoktatási Intézmény Tveri Állami Egyetem Fizikai és Technológiai Kar Általános Fizikai Tanszék JÓVÁHAGYOTT A Fizikai és Technológiai Kar dékánja B.B. Pedko 2012 AZ ATOMMAG FIZIKÁJA ÉS ELEMI RÉSZecskék tudományág munkaprogramja 3. évfolyamos nappali tagozatos hallgatóknak Irány 222000.62 - Innováció, profil Innováció Menedzsment (ágazatonként és területenként..." „AZ OROSZ ÁLLAMI OKTATÁSTUDOMÁNYI MINISZTÉRIUM SZAKMAI FELSŐOKTATÁSI INTÉZMÉNY VORONEZSI ÁLLAMI EGYETEM (GOU VPO VSU) JÓVÁHAGYOTT A Munkajogi Tanszék vezetője Perederin S.V. 2011. 01. 21. A tudományos tudományág munkaprogramja B 3.b.13 Földjog 1. A képzési irány/szakterület titkosítása és megnevezése: 030900 Jogtudomány 2. Képzés/szak profilja: jogtudomány_ 3. Szakképzettség (fokozat) a végzett: jogtudományi bachelor_ 4. Forma .. forma .. ." „A munkaprogramot a szövetségi állami felsőoktatási oktatási szabvány alapján állították össze, figyelembe véve a 130400.65 Bányászat, szakirány 130400.65.10 A bányászati termelés villamosítása és automatizálása Hozzávetőleges szakemberképzési alapképzési program ajánlásait. 1. A tudományág elsajátításának céljai Az Elektromos gépek tudományág fő célja a hallgatók elméleti alapjainak fejlesztése a modern elektromechanikai ... " „Tartalom I. Magyarázó megjegyzés 3 II. A stratégiai fejlesztési program 6. végrehajtása során 2013-ban elért főbb eredmények III. 2. mellékletek I. Magyarázat Az egyetem stratégiai fejlesztési programjának céljai és célkitűzései a program teljes időtartama alatt változatlanok, és a végrehajtás minden évében fokozatosan megvalósulnak, biztosítva a jegyzett program mellékletében meghatározott mutatók elérését. . 1. cél Fejlett oktatási technológiák fejlesztése Cél...” „Az Orosz Föderáció Oktatási és Tudományos Minisztériuma Az Orosz Föderáció Szövetségi Oktatási Ügynöksége Vlagyivosztoki Állami Közgazdasági és Szolgáltatási Egyetem _ POLITIKAFILOZÓFIA A kurzus tanterve a 03020165 szakterületen, Politológia Vlagyivosztok Kiadó VGUES 2008 BBK 66.2 A tananyag A politikai filozófiát az Orosz Föderáció felsőoktatási állami oktatási szabványának követelményei szerint állítják össze. A kurzus témája a politika, mint összetett társadalmi jelenség, értékei és céljai, a technológiák és...” „MINŐSÉGRENDSZER JELÖLT VIZSGAPROGRAM SPECIÁLISAN o. 2 / 5 05.16.04 ÖNTÖDÉSI TERMELÉS A szakvizsgán a vizsgázói vizsga ezen kérdéseit az Orosz Föderáció Oktatási és Tudományos Minisztériumának rendelete által jóváhagyott 05.16.04 Öntöde szakvizsgára vonatkozó vizsgázói programnak megfelelően állítjuk össze. 2007.10.08. 274. sz. 1 KÉRDÉSLISTA 1. A gépgyártásban használt öntött ötvözetek osztályozása. Az ötvözetek alapvető paraméterei: olvadáspont,..." „Állami Autonóm Oktatási Intézmény munkaügyi igazgatójának ülésén megfontolva és elfogadva V. V. Malkov M SPO MKETI főiskolai állomány, jegyzőkönyv _ 2013 kelt_ Hosszú távú célprogram A Murmanszki Gazdasági és Információs Technológiai Főiskola fejlesztése 2013-ra -2015 Murmansk 2013 2 1. Főiskolai Fejlesztési Program útlevél. Megnevezés Hosszú távú célprogram A Murmanszki Gazdasági és Informatikai Főiskola 2013. évi programjának fejlesztése (a továbbiakban: Program) Az Orosz Föderáció törvényének alapja től...” "Az Orosz Föderáció Oktatási és Tudományos Minisztériuma Szövetségi Állami Költségvetési Felsőoktatási Szakmai Oktatási Intézmény MOSZKVA ÁLLAMI ERDÉSZETI EGYETEM Erdészeti Kar Műerdészeti Tanszék a s h i n a i m a n i z a t i o n i z a t i o n i z a t i o n i z a t i o n i z a t i o n i n l / UJA MÁZÁRA MEGJEGYZÉS / Mezőgazdasági munka JÓVÁHAGYOTT A P^JG: OJBJJ JÓVÁHAGYVA *PROGRAM OF FELVÉTELI VIZSGÁLAT UTÁNI TANULMÁNYBA Szakági Erdészeti Növénytermesztési Tanszék Mesterséges..." „SZÖVETSÉGI POLGÁRI REPÜLÉSI ÜGYNÖKSÉG MOSZKVA ÁLLAMI MŰSZAKI EGYETEM POLGÁRI REPÜLÉSI EGYETEME JÓVÁHAGYOTT Az MMR rektorhelyettese V.V. Krinitsin _2007. A FEJEZET MUNKA OKTATÁSI PROGRAMJA Termodinamika és hőátadás, SD.04 (név, kód GOS szerint) Szakterület 160901 Repülőgépek és hajtóművek műszaki üzemeltetése (GOS szerinti kód) Kar - Mechanikai Tanszék - Repülőgép motorok Tantárgy - 3 Tanulmányi forma - nappali tagozatos félév A képzési órák összmennyisége a...” “MC45 b FELHASZNÁLÓI ÚTMUTATÓ MC45 Felhasználói kézikönyv 72E-164159-01HU Rev. B 2013. január ii MC45 Felhasználói kézikönyv A Motorola írásos engedélye nélkül ennek a kiadványnak egyetlen része sem reprodukálható vagy felhasználható semmilyen formában vagy bármilyen elektromos vagy mechanikus eszközzel. Ide tartoznak az elektronikus vagy mechanikus fénymásoló vagy rögzítő eszközök, valamint az információtároló és -visszakereső eszközök...” „A munkaprogram kidolgozása a következők alapján történt: 1. Szövetségi Állami Oktatási Szabvány a Felsőoktatási Alapképzés irányába 560800 Agrármérnökség, jóváhagyva 2000.05.04-én (nyilvántartási szám: 313 s/bak). 2. A Gépelmélet alapjai tudományág hozzávetőleges programja, jóváhagyva 2001. június 27-én. 3. Munkaterv, az egyetem tudományos tanácsa által jóváhagyott 2013.04.22., 4. szám. Vezető tanár: Ablikov V.A., egyetemi tanár _ Ablikov 13.06.16. Tanárok: Ablikov V.A., professzor _ Ablikov 13.06.16 Sokht K.A., professzor _...” „AZ OROSZ FÖDERÁCIÓ MEZŐGAZDASÁGI MINISZTÉRIUMA Szakmai Felsőoktatási Szövetségi Állami Költségvetési Oktatási Intézmény Moszkvai Állami Agrármérnöki Egyetem, V.P. Goryachkina GÉPJAVÍTÁSI ÉS MEGBÍZHATÓSÁGI TANSZÉK Jóváhagyta: Levelező Oktatási Kar dékánja P.A. Silaichev “_” _ 2013. MUNKAPROGRAM Szakterület 190601 - Gépjármű- és járműipar Szakirány 653300 - Szárazföldi szállítás félév - Működtetése... |
A bioszerves kémia olyan tudomány, amely az életfolyamatokban részt vevő anyagok szerkezetét és tulajdonságait vizsgálja, közvetlenül összefüggésben biológiai funkcióik ismeretével.
A bioorganikus kémia az a tudomány, amely biológiailag jelentős vegyületek szerkezetét és reakcióképességét vizsgálja. A bioszerves kémia tárgya a biopolimerek és bioregulátorok és szerkezeti elemeik.
A biopolimerek közé tartoznak a fehérjék, poliszacharidok (szénhidrátok) és nukleinsavak. Ebbe a csoportba tartoznak a lipidek is, amelyek nem BMC-k, de általában a szervezetben más biopolimerekhez kapcsolódnak.
A bioregulátorok olyan vegyületek, amelyek kémiailag szabályozzák az anyagcserét. Ide tartoznak a vitaminok, hormonok és számos szintetikus vegyület, beleértve a gyógyászati anyagokat is.
A bioszerves kémia a szerves kémia elgondolásain és módszerein alapul.
A szerves kémia általános elveinek ismerete nélkül nehéz a bioszerves kémiát tanulmányozni. A bioszerves kémia szorosan kapcsolódik a biológiához, a biológiai kémiához és az orvosi fizikához.
A szervezet körülményei között végbemenő reakciók halmazát ún anyagcsere.
Az anyagcsere során keletkező anyagok ún. metabolitok.
Az anyagcserének két iránya van:
A katabolizmus az összetett molekulák egyszerűbb molekulákká való bomlásának reakciója.
Az anabolizmus az a folyamat, amikor egyszerűbb anyagokból összetett molekulákat szintetizálnak energia felhasználásával.
A bioszintézis kifejezést egy kémiai reakcióra alkalmazzák IN VIVO (a testben), IN VITRO (testen kívül)
Vannak antimetabolitok - a metabolitok versenytársai a biokémiai reakciókban.
A konjugáció, mint a molekulák stabilitását növelő tényező. Az atomok kölcsönös hatása szerves vegyületek molekuláiban és átvitelének módjai
Az előadás vázlata:
Párosítás és típusai:
p, p - párosítás,
r,p - ragozás.
Konjugációs energia.
Nyitott áramkörű kapcsolt rendszerek.
A-vitamin, karotinok.
Konjugáció gyökökben és ionokban.
Csatolt zárt láncú rendszerek. Aromás, aromás kritériumok, heterociklusos aromás vegyületek.
Kovalens kötés: nem poláris és poláris.
Induktív és mezomer hatások. Az EA és az ED helyettesítők.
A szerves kémiában a kémiai kötések fő típusai a kovalens kötések. A szerves molekulákban az atomok s és p kötésekkel kapcsolódnak egymáshoz.
A szerves vegyületek molekuláiban lévő atomokat kovalens kötések kötik össze, amelyeket s és p kötéseknek nevezünk.

Az egyszeres s - kötés SP 3 - hibridizált állapotban az l - hosszúság (C-C 0,154 nm), E-energia (83 kcal/mol), polaritás és polarizálhatóság jellemzi. Például:

A telítetlen vegyületekre jellemző a kettős kötés, amelyben a központi s-kötésen kívül az s-kötésre merőleges átfedés is van, amit π-kötésnek nevezünk).
A kettős kötések lokalizáltak, vagyis az elektronsűrűség csak a kötött atomok 2 magját fedi le.

Leggyakrabban te és én fogunk foglalkozni konjugált rendszerek. Ha a kettős kötések váltakoznak egyes kötéssel (és általános esetben a kettős kötéshez kapcsolódó atomnak p-pályája van, akkor a szomszédos atomok p-pályái átfedhetik egymást, közös p-elektronrendszert alkotva). Az ilyen rendszereket ún konjugált vagy delokalizált . Például: butadién-1,3

p, p - konjugált rendszerek
A butadiénben lévő összes atom SP 2 hibridizált állapotban van, és ugyanabban a síkban helyezkedik el (Pz nem hibrid orbitális). Рz – a pályák párhuzamosak egymással. Ez megteremti a kölcsönös átfedésük feltételeit. A Pz pálya átfedése C-1 és C-2 és C-3 és C-4, valamint C-2 és C-3 között történik, azaz előfordul delokalizált kovalens kötés. Ez a molekula kötéshosszának változásában tükröződik. A C-1 és C-2 közötti kötés hossza megnő, a C-2 és C-3 között pedig lerövidül az egyszeres kötéshez képest.
l-C -С, 154 nm l С=С 0,134 nm
l С-N 1,147 nm l С =O 0,121 nm

r, p - párosítás
P, π konjugált rendszerre példa a peptidkötés.

r, p - konjugált rendszerek
A C=0 kettős kötés a szokásos 0,121 nm-hez képest 0,124 nm-re bővül, a C–N kötés pedig lerövidül és 0,132 nm-re változik a normál esetben 0,147 nm-hez képest. Vagyis az elektrondelokalizáció folyamata a kötéshosszak kiegyenlítődéséhez és a molekula belső energiájának csökkenéséhez vezet. A ρ,p – konjugáció azonban aciklusos vegyületekben fordul elő, nemcsak akkor, ha váltakoznak = kötések egyszeres C-C kötéssel, hanem akkor is, ha heteroatommal váltakoznak:

A kettős kötés közelében egy szabad p-pályával rendelkező X atom is elhelyezkedhet. Leggyakrabban ezek O, N, S heteroatomok és p-pályáik, amelyek kölcsönhatásba lépnek p-kötésekkel, p, p-konjugációt hozva létre.
Például:
CH 2 = CH – O – CH = CH 2
A konjugáció nem csak semleges molekulákban, hanem gyökökben és ionokban is előfordulhat:

A fentiek alapján nyílt rendszerekben a párosítás a következő feltételek mellett történik:
A konjugált rendszerben részt vevő összes atom SP 2 - hibridizált állapotban van.
Pz – az összes atom pályája merőleges az s-váz síkjára, azaz párhuzamos egymással.
Ha egy konjugált többközpontú rendszer jön létre, a kötéshosszak kiegyenlítődnek. Itt nincsenek „tiszta” egyszeres és kettős kötések.
A p-elektronok delokalizációja konjugált rendszerben energia felszabadulással jár. A rendszer alacsonyabb energiaszintre lép, stabilabbá, stabilabbá válik. Így a konjugált rendszer kialakulása butadién - 1,3 esetén 15 kJ/mol energia felszabadulásához vezet. A konjugációnak köszönhető, hogy az allil típusú iongyökök stabilitása és a természetben való elterjedtsége nő.
Minél hosszabb a konjugációs lánc, annál nagyobb a keletkezésének energiája.
Ez a jelenség meglehetősen elterjedt a biológiailag fontos vegyületekben. Például:


Folyamatosan találkozunk a molekulák, ionok és gyökök termodinamikai stabilitásának kérdéseivel a bioszerves kémia során, amely számos, a természetben elterjedt iont és molekulát magában foglal. Például: 
Zárt hurkú kapcsolt rendszerek
Aromás. A ciklikus molekulákban bizonyos körülmények között konjugált rendszer jöhet létre. P, p - konjugált rendszerre példa a benzol, ahol a p - elektronfelhő szénatomokat takar, egy ilyen rendszert nevezünk - aromás.
A benzolban való konjugációból származó energianyereség 150,6 kJ/mol. Ezért a benzol termikusan 900 o C hőmérsékletig stabil.
A zárt elektrongyűrű jelenlétét NMR segítségével igazoltuk. Ha egy benzolmolekulát külső mágneses térbe helyezünk, induktív gyűrűáram lép fel.
Így a Hückel által megfogalmazott aromás kritérium a következő:
a molekula ciklikus szerkezetű;
minden atom SP 2 – hibridizált állapotban van;
van egy delokalizált p - elektronrendszer, amely 4n + 2 elektront tartalmaz, ahol n a ciklusok száma.
Például: 
A bioszerves kémiában különleges helyet foglal el a kérdés heterociklusos vegyületek aromássága.
A heteroatomokat (nitrogén, kén, oxigén) tartalmazó ciklusos molekulákban egyetlen p-elektronfelhő képződik szénatomok p-pályáinak és egy heteroatom részvételével.
Öttagú heterociklusos vegyületek

Az aromás rendszer 4 p-pálya C és egy heteroatom egy pályájának kölcsönhatásából jön létre, amely 2 elektront tartalmaz. Hat p elektron alkotja az aromás vázat. Egy ilyen konjugált rendszer elektronikusan redundáns. A pirrolban az N atom SP 2 hibridizált állapotban van.
A pirrol számos biológiailag fontos anyag része. Négy pirrolgyűrű alkot porfint, egy aromás rendszert 26 p-elektronnal és nagy konjugációs energiával (840 kJ/mol)
A porfin szerkezete a hemoglobin és a klorofill része 

Hattagú heterociklusos vegyületek
Ezeknek a vegyületeknek a molekuláiban az aromás rendszer öt szénatomos p-pálya és egy nitrogénatom egy p-pályájának kölcsönhatása révén jön létre. Két SP 2 pályán két elektron vesz részt az s - kötések kialakításában a gyűrű szénatomjaival. Az egy elektronos P-pálya az aromás vázban található. SP 2 – egy pálya egyetlen elektronpárral az s-váz síkjában fekszik.
A pirimidinben az elektronsűrűség N felé tolódik el, vagyis a rendszer kimerült a p - elektronoktól, elektronhiányos.
Sok heterociklusos vegyület tartalmazhat egy vagy több heteroatomot 
A pirrol, pirimidin és purin magok számos biológiailag aktív molekula részét képezik.
Az atomok kölcsönös hatása szerves vegyületek molekuláiban és átvitelének módjai
Amint már említettük, a szerves vegyületek molekuláiban a kötések s és p kötések révén jönnek létre; az elektronsűrűség csak akkor oszlik meg egyenletesen a kötött atomok között, ha ezek az atomok azonosak vagy közeli elektronegativitásúak. Az ilyen kapcsolatokat ún nem poláris. 
CH3-CH2 →CI poláris kötés
A szerves kémiában gyakrabban foglalkozunk poláris kötésekkel.
Ha az elektronsűrűséget egy elektronegatívabb atom felé toljuk el, akkor az ilyen kötést polárisnak nevezzük. A kötési energia értékei alapján L. Pauling amerikai kémikus az atomok elektronegativitásának kvantitatív jellemzőjét javasolta. Alul látható a Pauling-skála.
Na Li H S C J Br Cl N O F
0,9 1,0 2,1 2,52,5 2,5 2,8 3,0 3,0 3,5 4,0
A hibridizáció különböző állapotaiban lévő szénatomok elektronegativitása különbözik. Ezért az s - az SP 3 és SP 2 hibridizált atomok közötti kötés - poláris 
Induktív hatás
Az elektronsűrűség átvitelét az elektrosztatikus indukció mechanizmusán keresztül s-kötések lánca mentén ún. indukcióval, a hatás az úgynevezett induktívés J-vel jelöljük. J hatása általában három kötésen keresztül gyengül, de a közeli atomok a közeli dipólus meglehetősen erős hatását tapasztalják.
Azok a szubsztituensek, amelyek az elektronsűrűséget az s-kötési lánc mentén a maguk irányába tolják el, -J – hatást mutatnak, és fordítva +J effektust. 

Egy izolált p-kötés, valamint egy nyitott vagy zárt konjugált rendszer egyetlen p-elektronfelhője könnyen polarizálható EA és ED szubsztituensek hatására. Ezekben az esetekben az induktív hatás átkerül a p-kapcsolatra, ezért Jp-vel jelöljük. 
Mezomer hatás (konjugációs hatás)
Az elektronsűrűség újraeloszlását egy konjugált rendszerben egy olyan szubsztituens hatására, amely ennek a konjugált rendszernek a tagja, ún. mezomer hatás(M-hatás). 
Ahhoz, hogy egy szubsztituens egy konjugált rendszer része legyen, vagy kettős kötéssel (p,p konjugáció) vagy heteroatommal kell rendelkeznie magányos elektronpárral (r,p konjugáció). M – a hatást csillapítás nélkül továbbítják a csatolt rendszeren.
Azok a szubsztituensek, amelyek konjugált rendszerben csökkentik az elektronsűrűséget (az elektronsűrűség az irányába eltolódik), -M hatást, a konjugált rendszerben az elektronsűrűséget növelő szubsztituensek pedig +M hatást mutatnak.
Szubsztituensek elektronikus hatásai 
A szerves anyagok reakcióképessége nagymértékben függ a J és M hatás természetétől. Az elektronikus hatások elméleti lehetőségeinek ismerete lehetővé teszi bizonyos kémiai folyamatok lefolyásának előrejelzését.
Szerves vegyületek sav-bázis tulajdonságai Szerves reakciók osztályozása.
Előadás vázlata
A szubsztrát, nukleofil, elektrofil fogalma.
A szerves reakciók osztályozása.
visszafordítható és visszafordíthatatlan
radikális, elektrofil, nukleofil, szinkron.
mono- és bimolekuláris
helyettesítési reakciók
addíciós reakciók
eliminációs reakciók
oxidáció és redukció
sav-bázis kölcsönhatások
A reakciók regioszelektívek, kemoszelektívek, sztereoszelektívek.
Elektrofil addíciós reakciók. Morkovnyikov uralma, Morkovnyikov-ellenes csatlakozás.
Elektrofil szubsztitúciós reakciók: 1. és 2. típusú orientánsok.
A szerves vegyületek sav-bázis tulajdonságai.
Bronsted savasság és bázikusság
Lewis savasság és bázikusság
Kemény és lágy savak és bázisok elmélete.
A szerves reakciók osztályozása
A szerves reakciók rendszerezése lehetővé teszi, hogy ezeknek a reakcióknak a sokféleségét viszonylag kis számú típusra csökkentsük. A szerves reakciók osztályozhatók:
felé: visszafordítható és visszafordíthatatlan
a szubsztrátumban és a reagensben bekövetkező kötések változásainak természete szerint.
Szubsztrát– olyan molekula, amely szénatomot biztosít új kötés kialakításához
Reagens- az aljzatra ható vegyület.
A szubsztrátban és a reagensben bekövetkezett kötések változásának természete alapján a reakciók a következőkre oszthatók:
radikális R
elektrofil E
nukleofil N(Y)
szinkron vagy koordinált 

Az SR-reakciók mechanizmusa
Megindítás, inicializálás
Lánc növekedés
Nyitott áramkör 
OSZTÁLYOZÁS VÉGSŐ EREDMÉNY SZERINT
A reakció végeredményének egyezése a következő:
A) szubsztitúciós reakciók
B) addíciós reakciók
B) eliminációs reakciók
D) átcsoportosítások
D) oxidáció és redukció
E) sav-bázis kölcsönhatások
Reakciók is előfordulnak:
Regioszelektív– lehetőleg több reakcióközpont valamelyikén áramlik át.
Kemoszelektív– preferenciális reakció valamelyik rokon funkciós csoportra.
Sztereoszelektív– a több sztereoizomer egyikének preferenciális képzése.
Alkének, alkánok, alkadiének, arének és heterociklusos vegyületek reakciókészsége
A szerves vegyületek alapja a szénhidrogén. Csak azokat a reakciókat vesszük figyelembe, amelyeket biológiai körülmények között hajtanak végre, és ennek megfelelően nem magukkal a szénhidrogénekkel, hanem szénhidrogén gyökök részvételével.
A telítetlen szénhidrogének közé tartoznak az alkének, alkadiének, alkinek, cikloalkének és aromás szénhidrogének. Az egyesítő elv számukra a π – az elektronfelhő. Dinamikus körülmények között a szerves vegyületeket is megtámadja az E+
Az alkinok és arének reagensekkel való kölcsönhatási reakciói azonban eltérő eredményekhez vezetnek, mivel ezekben a vegyületekben a π - elektronfelhő természete eltérő: lokalizált és delokalizált.
A reakciómechanizmusok vizsgálatát az A E reakciókkal kezdjük. Mint tudjuk, az alkének kölcsönhatásba lépnek egymással 
A hidratációs reakció mechanizmusa
Markovnikov szabálya szerint - a telítetlen szénhidrogénekhez HX általános képletű aszimmetrikus vegyületek hozzáadása - hidrogénatomot adnak a leginkább hidrogénezett szénatomhoz, ha a szubsztituens ED. Az anti-Markovnikov addíciónál egy hidrogénatomot adnak a legkevésbé hidrogénezetthez, ha a szubsztituens EA.
Az aromás rendszerekben zajló elektrofil szubsztitúciós reakcióknak megvannak a maguk sajátosságai. Az első jellemző, hogy a termodinamikailag stabil aromás rendszerrel való kölcsönhatás erős elektrofileket igényel, amelyeket általában katalizátorok segítségével állítanak elő.
S E reakciómechanizmus 

TÁJÉKOZTATÓ BEFOLYÁS
HELYETTES
Ha van szubsztituens az aromás gyűrűben, akkor az szükségszerűen befolyásolja a gyűrű elektronsűrűségének eloszlását. ED - szubsztituensek (az 1. sor orientálói) CH 3, OH, OR, NH 2, NR 2 - elősegítik a szubsztitúciót a szubsztituálatlan benzolhoz képest, és a bejövő csoportot az orto- és para-helyzetbe irányítják. Ha az ED szubsztituensek erősek, akkor nincs szükség katalizátorra, ezek a reakciók 3 lépésben mennek végbe.
Az EA szubsztituensek (a második típusú orientánsok) gátolják az elektrofil szubsztitúciós reakciókat a szubsztituálatlan benzolhoz képest. Az SE reakció szigorúbb körülmények között megy végbe, a bejövő csoport metapozícióba kerül. A II típusú szubsztituensek a következők:
COOH, SO 3 H, CHO, halogének stb.
Az SE reakciók a heterociklusos szénhidrogénekre is jellemzőek. A pirrol, furán, tiofén és származékai a π-feleslegű rendszerek közé tartoznak, és meglehetősen könnyen lépnek be SE-reakciókba. Könnyen halogénezhetők, alkilezhetők, acilezhetők, szulfonálhatók és nitrálhatók. A reagensek kiválasztásakor figyelembe kell venni azok erősen savas környezetben való instabilitását, azaz az acidofóbicitást.
A piridin és más, piridin nitrogénatomot tartalmazó heterociklusos rendszerek π-elégtelen rendszerek, sokkal nehezebben indulnak SE reakciókba, és a bejövő elektrofil a nitrogénatomhoz képest a β-helyzetet foglalja el. 
A szerves vegyületek savas és bázikus tulajdonságai
A szerves vegyületek reakcióképességének legfontosabb szempontjai a szerves vegyületek sav-bázis tulajdonságai.
Savasság és bázikusság fontos fogalmak is, amelyek a szerves vegyületek számos funkcionális fizikai-kémiai és biológiai tulajdonságát határozzák meg. A savas és bázisos katalízis az egyik leggyakoribb enzimes reakció. A gyenge savak és bázisok a biológiai rendszerek gyakori összetevői, amelyek fontos szerepet játszanak az anyagcserében és annak szabályozásában.
A szerves kémiában számos sava- és bázisfogalom létezik. A savak és bázisok Brønsted-elmélete, általánosan elfogadott a szervetlen és szerves kémiában. Brønsted szerint a savak olyan anyagok, amelyek protont adhatnak, a bázisok pedig olyan anyagok, amelyek képesek protont fogadni. 
Bronsted savasság
Elvileg a legtöbb szerves vegyület savnak tekinthető, mivel a szerves vegyületekben a H C-hoz kötődik, N O S
A szerves savakat rendre C – H, N – H, O – H, S-H – savakra osztják. 


A savasságot Ka vagy - log Ka = pKa formában értékeljük, minél alacsonyabb a pKa, annál erősebb a sav.
A szerves vegyületek savasságának mennyiségi értékelését nem minden szerves anyag esetében határozták meg. Ezért fontos fejleszteni azt a képességet, hogy minőségi értékelést lehessen végezni a különböző savas helyek savas tulajdonságairól. Erre a célra általános módszertani megközelítést alkalmaznak.
A sav erősségét az anion (konjugált bázis) stabilitása határozza meg. Minél stabilabb az anion, annál erősebb a sav.
Az anion stabilitását számos tényező kombinációja határozza meg:
a savközpontban lévő elem elektronegativitása és polarizálhatósága.
a negatív töltés delokalizációjának mértéke az anionban.
a savközponthoz kapcsolódó gyök természete.
szolvatációs hatások (oldószer hatása)
Nézzük meg egymás után ezeknek a tényezőknek a szerepét:
Az elemek elektronegativitásának hatása
Minél elektronegatívabb az elem, annál delokalizáltabb a töltés és minél stabilabb az anion, annál erősebb a sav.
C (2,5) N (3,0) O (3,5) S (2,5)
Ezért a CH sorozat savassága megváltozik< NН < ОН Az SH savak esetében egy másik tényező dominál - a polarizálhatóság. A kénatom nagyobb méretű, és üres d-pályái vannak. ezért a negatív töltés nagy térfogatban képes delokalizálódni, ami az anion nagyobb stabilitását eredményezi. A tiolok, mint erősebb savak lúgokkal, valamint nehézfémek oxidjaival és sóival, míg az alkoholok (gyenge savak) csak aktív fémekkel lépnek reakcióba. A tols viszonylag magas savtartalmát az orvostudományban és a gyógyszerkémiában alkalmazzák. Például: As, Hg, Cr, Bi mérgezésre használják, melynek hatása a fémek megkötésének és a szervezetből való eltávolításának köszönhető. Például: A savcentrumban azonos atomot tartalmazó vegyületek savasságának megítélésekor az anion negatív töltésének delokalizációja a meghatározó. Az anion stabilitása jelentősen növekszik a negatív töltés delokalizációjának lehetőségével a konjugált kötésrendszer mentén. A fenolok savasságának jelentős növekedése az alkoholokhoz képest az ionok delokalizációjának lehetőségével magyarázható a molekulához képest. A karbonsavak magas savassága a karboxilát anion rezonanciastabilitásából adódik A töltésdelokalizációt az elektronvonó szubsztituensek (EA) jelenléte segíti elő, ezek stabilizálják az anionokat, ezáltal növelik a savasságot. Például egy szubsztituens bevitele egy EA molekulába A szubsztituens és az oldószer hatása a - hidroxisavak erősebb savak, mint a megfelelő karbonsavak. Az ED - szubsztituensek éppen ellenkezőleg, csökkentik a savasságot. Az oldószerek nagyobb hatással vannak az anion stabilizálására, általában a kis ionok, amelyek töltésdelokalizációja alacsony, jobban szolvatálódnak. A megoldás hatása nyomon követhető például a sorozatban: Ha egy savas centrumban lévő atom pozitív töltést hordoz, az megnövekedett savassághoz vezet. Kérdés a hallgatósághoz: melyik savnak – ecetsav vagy palmitinsav C 15 H 31 COOH – legyen alacsonyabb a pKa értéke? Ha a savcentrumban lévő atom pozitív töltést hordoz, az megnövekedett savassághoz vezet. Megfigyelhető az elektrofil szubsztitúciós reakcióban keletkező σ - komplex erős CH - savassága. Bronsted bázikusság A protonnal való kötés kialakításához megosztatlan elektronpárra van szükség a heteroatomon, vagy legyen anion. Vannak p-bázisok és π bázisok, ahol a bázikusság középpontja van egy lokalizált π kötés elektronjai vagy egy konjugált rendszer π elektronjai (π komponensek) A bázis erőssége ugyanazoktól a tényezőktől függ, mint a savasság, de hatásuk ellentétes. Minél nagyobb egy atom elektronegativitása, annál szorosabban tartja meg a magányos elektronpárt, és annál kevésbé alkalmas a protonhoz való kötésre. Ekkor általában az azonos szubsztituenssel rendelkező n-bázisok erőssége változik a sorozatban: A legalapvetőbb szerves vegyületek az aminok és az alkoholok: A szerves vegyületek ásványi savakkal alkotott sói jól oldódnak. Sok gyógyszert sók formájában használnak. Sav-bázis központ egy molekulában (amfoter) Hidrogénkötések mint sav-bázis kölcsönhatások Minden α-aminosav esetében túlsúlyban vannak a kationos formák erősen savas és anionosak erősen lúgos környezetben. A gyenge savas és bázikus centrumok jelenléte gyenge kölcsönhatásokhoz - hidrogénkötésekhez - vezet. Például: az alacsony molekulatömegű imidazolnak magas a forráspontja a hidrogénkötések jelenléte miatt. J. Lewis a savak és bázisok általánosabb elméletét javasolta, amely az elektronikus héjak szerkezetén alapul. A Lewis-sav lehet olyan atom, molekula vagy kation, amelynek van egy üres pályája, amely képes elektronpárt fogadni, hogy kötést hozzon létre. A Lewis-savak képviselői a D.I. periodikus rendszer II. és III. csoportjába tartozó elemek halogenidjei. Mengyelejev. A Lewis-bázisok olyan atomok, molekulák vagy anionok, amelyek elektronpárt képesek átadni. A Lewis-bázisok közé tartoznak az aminok, alkoholok, éterek, tiolok, tioéterek és π-kötéseket tartalmazó vegyületek. Például az alábbi kölcsönhatás Lewis sav-bázis kölcsönhatásként ábrázolható Lewis elméletének fontos következménye, hogy bármely szerves anyag reprezentálható sav-bázis komplexként. A szerves vegyületekben az intramolekuláris hidrogénkötések sokkal ritkábban fordulnak elő, mint az intermolekulárisok, de bioorganikus vegyületekben is előfordulnak, és sav-bázis kölcsönhatásnak tekinthetők. A „kemény” és a „lágy” fogalma nem azonos az erős és gyenge savakkal és bázisokkal. Ez két független jellemző. Az LCMO lényege, hogy a kemény savak kemény bázisokkal, a lágy savak pedig a lágy bázisokkal reagálnak. Pearson kemény és lágy savak és bázisok (HABP) elve szerint a Lewis-savakat keményre és lágyra osztják. A kemény savak kis méretű, nagy pozitív töltésű, nagy elektronegativitású és alacsony polarizálhatóságú akceptor atomok. A lágy savak nagy akceptor atomok kis pozitív töltéssel, alacsony elektronegativitással és nagy polarizálhatósággal. Az LCMO lényege, hogy a kemény savak kemény bázisokkal, a lágy savak pedig a lágy bázisokkal reagálnak. Például: Szerves vegyületek oxidációja és redukciója A redox reakciók rendkívül fontosak az életfolyamatok szempontjából. Segítségükkel a szervezet kielégíti energiaszükségletét, hiszen a szerves anyagok oxidációja során energia szabadul fel. Másrészt ezek a reakciók arra szolgálnak, hogy a táplálékot sejtkomponensekké alakítsák. Az oxidációs reakciók elősegítik a méregtelenítést és a gyógyszerek eltávolítását a szervezetből. Az oxidáció a hidrogén eltávolításának folyamata többszörös kötés vagy új, polárisabb kötések kialakítása céljából. A redukció az oxidáció fordított folyamata. A szerves szubsztrátok oxidációja könnyebben megy végbe, annál erősebb az elektronfeladási hajlam. Az oxidációt és a redukciót a vegyület meghatározott osztályaival összefüggésben kell figyelembe venni. C-H kötések (alkánok és alkilok) oxidációja Amikor az alkánok teljesen égnek, CO 2 és H 2 O képződik, és hő szabadul fel. Oxidációjuk és redukciójuk egyéb módjait a következő sémák mutatják be: A telített szénhidrogének oxidációja zord körülmények között megy végbe (a króm keverék forró), a lágyabb oxidálószerek nincsenek hatással rájuk. Közbenső oxidációs termékek az alkoholok, aldehidek, ketonok és savak. Az R – O – OH hidroperoxidok a C – H kötések enyhe körülmények között történő oxidációjának legfontosabb köztes termékei, különösen in vivo A C–H kötések egyik fontos oxidációs reakciója testkörülmények között az enzimatikus hidroxilezés. Példa erre az alkoholok előállítása az élelmiszerek oxidációjával. A molekuláris oxigén és annak aktív formái miatt. in vivo végzett. A hidrogén-peroxid hidroxilálószerként szolgálhat a szervezetben. A felesleges peroxidot kataláznak kell lebontania vízre és oxigénre. Az alkének oxidációja és redukciója a következő átalakulásokkal ábrázolható: Alkén redukció Aromás szénhidrogének oxidációja és redukciója A benzol rendkívül nehezen oxidálható még zord körülmények között is a következő séma szerint: Az oxidációs képesség jelentősen megnövekszik a benzolról naftalinra és tovább antracénre. Az ED szubsztituensek elősegítik az aromás vegyületek oxidációját. EA – gátolja az oxidációt. A benzol visszanyerése. C 6 H 6 + 3 H 2 Aromás vegyületek enzimatikus hidroxilezése Alkoholok oxidációja A szénhidrogénekhez képest az alkoholok oxidációja enyhébb körülmények között megy végbe A diolok legfontosabb reakciója testkörülmények között a kinon-hidrokinon rendszerben való átalakulás Az elektronok átvitele a szubsztrátból az oxigénbe a metakondriumokban történik. Aldehidek és ketonok oxidációja és redukciója A szerves vegyületek egyik legkönnyebben oxidálható osztálya 2H 2 C = O + H 2 O CH 3 OH + HCOOH különösen könnyen áramlik a fényben Nitrogéntartalmú vegyületek oxidációja Az aminok meglehetősen könnyen oxidálódnak, az oxidáció végtermékei nitrovegyületek A nitrogéntartalmú anyagok kimerítő redukciója aminok képződéséhez vezet. Aminok oxidációja in vivo A tiolok oxidációja és redukciója Szerves vegyületek O-B tulajdonságainak összehasonlító jellemzői. A tiolok és a 2 atomos fenolok oxidálódnak legkönnyebben. Az aldehidek meglehetősen könnyen oxidálódnak. Az alkoholok nehezebben oxidálódnak, az elsődlegesek pedig könnyebben, mint a másodlagosak és a tercierek. A ketonok ellenállnak az oxidációnak, vagy a molekula hasadásával oxidálódnak. Az alkinek még szobahőmérsékleten is könnyen oxidálódnak. A legnehezebben oxidálhatók az Sp3-hibridizált állapotban lévő szénatomot tartalmazó vegyületek, vagyis a molekulák telített töredékei. ED – a szubsztituensek elősegítik az oxidációt EA – gátolja az oxidációt. Poli- és heterofunkciós vegyületek sajátos tulajdonságai. Előadás vázlata A poli- és heterofunkcionalitás, mint a szerves vegyületek reakcióképességét növelő tényező. A poli- és heterofunkciós vegyületek sajátos tulajdonságai: intramolekuláris sók amfoteritása. γ, δ, ε – heterofunkcionális vegyületek intramolekuláris ciklizációja. intermolekuláris ciklizáció (laktidok és deketopipirozinok) kelátképző. béta-heterofunkcionális eliminációs reakciói kapcsolatokat. keto-enol tautoméria. Foszfenolpiruvát, mint makroerg vegyület. dekarboxilezés. sztereoizoméria Poli- és heterofunkcionalitás, mint specifikus tulajdonságok megjelenésének oka a hidroxi-, amino- és oxosavakban. A biológiailag fontos szerves vegyületekre jellemző, hogy egy molekulában több azonos vagy eltérő funkciós csoport van jelen. Egy molekula két vagy több hidroxilcsoportot, aminocsoportot vagy karboxilcsoportot tartalmazhat. Például: A létfontosságú tevékenységben részt vevő anyagok fontos csoportja a heterofunkcionális vegyületek, amelyek különböző funkciós csoportok páronkénti kombinációját tartalmazzák. Például: Az alifás vegyületekben a fenti funkciós csoportok mindegyike EA karaktert mutat. Egymásra gyakorolt hatásuk következtében reaktivitásuk kölcsönösen fokozódik. Például az oxosavakban a két karbonil-szénatom mindegyikének elektrofilitását fokozza a másik funkciós csoport -J-je, ami a nukleofil reagensek könnyebb megtámadását eredményezi. Mivel az I effektus 3-4 kötés után elmúlik, fontos körülmény a funkciós csoportok elhelyezkedésének közelsége a szénhidrogénláncban. A heterofunkcionális csoportok elhelyezkedhetnek ugyanazon a szénatomon (α - elrendezés), vagy különböző szénatomokon, mind szomszédos (β elrendezés), mind egymástól távolabbi (γ, delta, epszilon) helyen. Mindegyik heterofunkcionális csoport megtartja saját reakcióképességét, pontosabban a heterofunkcionális vegyületek „kettős” számú kémiai reakcióba lépnek. Ha a heterofunkciós csoportok kölcsönös elrendeződése kellően szoros, akkor mindegyikük reakcióképessége kölcsönösen fokozódik. A savas és bázikus csoportok egyidejű jelenlétével a molekulában a vegyület amfoterné válik. Például: aminosavak. Heterofunkciós csoportok kölcsönhatása A gerofunkcionális vegyületek molekulája tartalmazhat olyan csoportokat, amelyek képesek kölcsönhatásba lépni egymással. Például amfoter vegyületekben, például α-aminosavakban belső sók képződése lehetséges. Ezért minden α-aminosav biopoláris ionok formájában fordul elő, és vízben jól oldódik. A sav-bázis kölcsönhatások mellett más típusú kémiai reakciók is lehetővé válnak. Például az S N reakció az SP 2-nél egy szénatom hibridje a karbonilcsoportban az alkoholcsoporttal való kölcsönhatás, észterek képződése, karboxilcsoport és aminocsoport (amidok képződése) következtében. A funkciós csoportok egymáshoz viszonyított elrendeződésétől függően ezek a reakciók egy molekulán belül (intramolekuláris) és molekulák között (intermolekulárisan) egyaránt előfordulhatnak. Mivel a reakció során ciklikus amidok és észterek képződnek. akkor a ciklusok termodinamikai stabilitása lesz a meghatározó tényező. E tekintetben a végtermék általában hat- vagy öttagú gyűrűket tartalmaz. Ahhoz, hogy az intramolekuláris kölcsönhatás egy öt- vagy hattagú észter (amid) gyűrűt hozzon létre, a heterofunkcionális vegyületnek gamma- vagy szigma-elrendezéssel kell rendelkeznie a molekulában. Aztán az osztályban Terv 1. Bioszerves kémia tárgya és jelentősége 2. Szerves vegyületek osztályozása és nómenklatúrája 3. Szerves molekulák ábrázolási módszerei 4. Kémiai kötések bioszerves molekulákban 5. Elektronikus hatások. Az atomok kölcsönös hatása egy molekulában 6. A kémiai reakciók és reagensek osztályozása 7. A kémiai reakciók mechanizmusainak fogalma 2
Bioszerves kémia tárgya 3 A bioszerves kémia a kémiai tudomány önálló ága, amely az élő szervezetek anyagcseréjében részt vevő szerves eredetű kémiai vegyületek szerkezetét, tulajdonságait és biológiai funkcióit vizsgálja.
A bioszerves kémia vizsgálati tárgyai az alacsony molekulatömegű biomolekulák és biopolimerek (fehérjék, nukleinsavak és poliszacharidok), bioregulátorok (enzimek, hormonok, vitaminok és mások), természetes és szintetikus fiziológiailag aktív vegyületek, beleértve a toxikus hatású gyógyszereket és anyagokat. A biomolekulák olyan bioorganikus vegyületek, amelyek az élő szervezetek részét képezik, és sejtszerkezetek kialakítására és biokémiai reakciókban való részvételre specializálódtak, az anyagcsere (anyagcsere) és általában az élő sejtek és a többsejtű szervezetek élettani funkcióinak alapját képezik. 4 Bioszerves vegyületek osztályozása
Az anyagcsere a szervezetben (in vivo) lejátszódó kémiai reakciók összessége. Az anyagcserét anyagcserének is nevezik. Az anyagcsere két irányban történhet - anabolizmus és katabolizmus. Az anabolizmus összetett anyagok szintézise a szervezetben viszonylag egyszerű anyagokból. Ez energiafelhasználással történik (endoterm folyamat). A katabolizmus éppen ellenkezőleg, az összetett szerves vegyületek lebontása egyszerűbbekre. Az energia felszabadulásával (exoterm folyamat) következik be. Az anyagcsere folyamatok enzimek részvételével zajlanak. Az enzimek biokatalizátorként játszanak szerepet a szervezetben. Enzimek nélkül a biokémiai folyamatok vagy egyáltalán nem, vagy nagyon lassan mennének végbe, és a szervezet nem lenne képes fenntartani az életet. 5
Bioelemek. A bioorganikus vegyületek összetétele a szénatomokon (C) kívül, amelyek bármely szerves molekula alapját képezik, hidrogént (H), oxigént (O), nitrogént (N), foszfort (P) és ként (S) is tartalmaz. . Ezek a bioelemek (organogének) az élő szervezetekben olyan mennyiségben koncentrálódnak, amely több mint 200-szor nagyobb, mint az élettelen tárgyakban. Az említett elemek a biomolekulák elemi összetételének több mint 99%-át teszik ki. 6
A bioszerves kémia a szerves kémia mélységeiből jött létre, és annak ötletein és módszerein alapul. A fejlődés történetében a szerves kémiának a következő szakaszai vannak: empirikus, analitikai, szerkezeti és modern. Az ember szerves anyagokkal való első megismerkedésétől a 18. század végéig tartó időszak empirikusnak tekinthető. Ennek az időszaknak a fő eredménye az volt, hogy az emberek felismerték az elemanalízis, az atom- és molekulatömeg megállapításának fontosságát. A vitalizmus elmélete - életerő (Berzelius). Az elemzési időszak a 19. század 60-as éveiig tartott. Jellemzője volt, hogy a 19. század első negyedének végétől számos ígéretes felfedezés született, amelyek megsemmisítő csapást mértek a vitalisztikus elméletre. A sorozat első tagja Berzelius tanítványa, a német kémikus, Wöhler volt. 1824-ben számos felfedezést tett - az oxálsav szintézisét cianogénből: (CN) 2 HOOC - COOH r. – karbamid szintézise ammónium-cianátból: NH 4 CNO NH 2 – C – NH 2 O 8
1853-ban C. Gerard kidolgozta a „típuselméletet”, és felhasználta a szerves vegyületek osztályozására. Gerard szerint az alábbi négy fő anyagtípusból lehet összetettebb szerves vegyületeket előállítani: HHHH típusú HHHH O típusú VÍZ H Cl típusú HIDROGÉN-KLORID HHHHN N típusú AMMÓNIA 1857-től F. A. Kekule javaslatára elkezdték a szénhidrogének osztályozását. mint metán típusú HHHNNHH C 9
A szerves vegyületek szerkezetének elméletének alapvetõ rendelkezései (1861) 1) a molekulák atomjai vegyértéküknek megfelelõen kémiai kötésekkel kapcsolódnak egymáshoz; 2) a szerves anyagok molekuláiban lévő atomok egy bizonyos sorrendben kapcsolódnak egymáshoz, amely meghatározza a molekula kémiai szerkezetét (szerkezetét); 3) a szerves vegyületek tulajdonságai nemcsak az őket alkotó atomok számától és jellegétől, hanem a molekulák kémiai szerkezetétől is függenek; 4) a szerves molekulákban kölcsönhatás lép fel az egymáshoz kötött és kötetlen atomok között; 5) egy anyag kémiai szerkezete meghatározható a kémiai átalakulások tanulmányozásával, és fordítva, tulajdonságai jellemezhetők az anyag szerkezetével. 10
A szerves vegyületek szerkezetének elméletének alapvető rendelkezései (1861) A szerkezeti képlet egy molekulában lévő atomok kötéseinek sorozatának képe. Bruttó képlet - CH 4 O vagy CH 3 OH Szerkezeti képlet Az egyszerűsített szerkezeti képleteket néha racionális molekulaképletnek nevezik - egy szerves vegyület képlete, amely a molekulában lévő egyes elemek atomjainak számát jelzi. Például: C 5 H 12 - pentán, C 6 H 6 - benzin stb. tizenegy
A bioszerves kémia fejlődési szakaszai A bioszerves kémia, mint külön tudományterület, amely egyrészt a szerves kémia fogalmi elveit és módszertanát, másrészt a molekuláris biokémiát és molekuláris farmakológiát ötvözi, a bioszerves kémia a XX. természetes anyagok és biopolimerek kémiája. A modern bioorganikus kémia alapvető jelentőségre tett szert W. Stein, S. Moore, F. Sanger (aminosav-összetétel elemzése és a peptidek és fehérjék elsődleges szerkezetének meghatározása), L. Pauling és H. Astbury (tisztázás) munkájának köszönhetően. a -hélix és -struktúra felépítéséről és jelentőségükről a fehérjemolekulák biológiai funkcióinak megvalósításában), E. Chargaff (a nukleinsavak nukleotid-összetételének sajátosságainak megfejtése), J. Watson, Fr. Crick, M. Wilkins, R. Franklin (a DNS-molekula térszerkezetének mintázatainak megállapítása), G. Corani (kémiai génszintézis) stb. 14
A szerves vegyületek osztályozása a szénváz szerkezete és a funkciós csoport jellege szerint A szerves vegyületek hatalmas száma késztette a vegyészeket osztályozásukra. A szerves vegyületek osztályozása két osztályozási szemponton alapul: 1. A szénváz szerkezete 2. A funkciós csoportok jellege Osztályozás a szénváz szerkezeti módszere szerint: 1. Aciklikus (alkánok, alkének, alkinok, alkadiének); 2. Ciklikus 2.1. Karbociklusos (aliciklusos és aromás) 2.2. Heterociklusos 15 Az aciklusos vegyületeket alifás vegyületeknek is nevezik. Ide tartoznak a nyitott szénláncú anyagok. Az aciklikus vegyületek telített (vagy telített) C n H 2n+2 (alkánok, paraffinok) és telítetlen (telítetlen) vegyületekre oszthatók. Ez utóbbiak közé tartoznak a C n H 2n alkének, C n H 2n -2 alkinek, C n H 2n -2 alkadiének.
16 A ciklikus vegyületek molekuláikon belül gyűrűket (ciklusokat) tartalmaznak. Ha a ciklusok csak szénatomokat tartalmaznak, akkor az ilyen vegyületeket karbociklusosnak nevezzük. A karbociklusos vegyületeket aliciklusos és aromás vegyületekre osztják. Az aliciklusos szénhidrogének (cikloalkánok) közé tartozik a ciklopropán és homológjai - ciklobután, ciklopentán, ciklohexán és így tovább. Ha a ciklusos rendszer a szénhidrogénen kívül más elemeket is tartalmaz, akkor az ilyen vegyületeket heterociklusosnak kell minősíteni.
Osztályozás a funkciós csoport jellege szerint A funkciós csoport egy olyan atom vagy atomok egy meghatározott módon összekapcsolt csoportja, amelynek jelenléte egy szerves anyag molekulájában meghatározza a jellemző tulajdonságait és a vegyületek egyik vagy másik osztályába való tartozását. . A funkciós csoportok száma és homogenitása alapján a szerves vegyületeket mono-, poli- és heterofunkciós csoportokra osztjuk. Az egy funkciós csoporttal rendelkező anyagokat monofunkciósnak, a több azonos funkciós csoporttal rendelkező anyagokat polifunkciósnak nevezzük. A több különböző funkciós csoportot tartalmazó vegyületek heterofunkcionálisak. Fontos, hogy az azonos osztályba tartozó vegyületeket homológ sorozatokba vonják össze. A homológ sorozat azonos funkciós csoportokkal és azonos szerkezetű szerves vegyületek sorozata, a homológ sorozat minden képviselője konstans egységgel (CH 2) különbözik az előzőtől, amit homológ különbségnek nevezünk. A homológ sorozat tagjait homológoknak nevezzük. 17
Nómenklatúrarendszerek a szerves kémiában - triviális, racionális és nemzetközi (IUPAC) A kémiai nómenklatúra az egyes kémiai anyagok, csoportjaik és osztályaik elnevezéseinek halmaza, valamint a nevük összeállításának szabályai A kémiai nómenklatúra az egyes vegyi anyagok elnevezéseinek összessége. anyagok, csoportjaik és osztályaik, valamint a nevük összeállításának szabályai. A triviális (történelmi) nómenklatúra az anyagok előállítási folyamatához kapcsolódik (pirogallol - a galluszsav pirolízisének terméke), a származási forráshoz, ahonnan származott (hangyasav) stb. A triviális vegyületneveket a természetes és heterociklusos vegyületek kémiájában széles körben használják (citrál, geraniol, tiofén, pirrol, kinolin stb.) A triviális (történelmi) nómenklatúra az anyagok beszerzési folyamatához kapcsolódik (a pirogallol pirolízis terméke galluszsav), a származási forrás, amelyből nyerték (hangyasav) stb. A vegyületek triviális elnevezéseit széles körben használják a természetes és heterociklusos vegyületek kémiájában (citrál, geraniol, tiofén, pirrol, kinolin stb.). A racionális nómenklatúra azon az elven alapul, hogy a szerves vegyületeket homológ sorozatokra osztják. Egy bizonyos homológ sorozatban lévő összes anyagot a sorozat legegyszerűbb képviselőjének származékának tekintik - az első vagy néha a második. Különösen az alkánok - metán, az alkének - etilén stb. esetében. A racionális nómenklatúra azon az elven alapul, hogy a szerves vegyületeket homológ sorozatokra osztják. Egy bizonyos homológ sorozatban lévő összes anyagot a sorozat legegyszerűbb képviselőjének származékának tekintik - az első vagy néha a második. Különösen az alkánokhoz - metánhoz, alkénekhez - etilénhez stb. 18
Nemzetközi nómenklatúra (IUPAC). A modern nómenklatúra szabályait 1957-ben dolgozták ki a Tiszta és Alkalmazott Kémia Nemzetközi Uniója (IUPAC) 19. kongresszusán. Radikális funkcionális nómenklatúra. Ezek az elnevezések a funkcionális osztály elnevezésén alapulnak (alkohol, éter, keton stb.), amelyet a szénhidrogén gyökök nevei előznek meg, például: allil-klorid, dietil-éter, dimetil-keton, propil-alkohol stb. Helyettesítő nómenklatúra. A nómenklatúra szabályai. Az anyaszerkezet a vegyület nevének alapjául szolgáló molekula szerkezeti fragmentuma (molekulaváz), az aliciklusos vegyületek esetében az atomok fő szénlánca, a karbociklusos vegyületek esetében pedig a ciklus. 19
Kémiai kötés szerves molekulákban A kémiai kötés a külső elektronhéjak (az atomok vegyértékelektronjai) és az atommagok közötti kölcsönhatás jelensége, amely meghatározza egy molekula vagy kristály egészének létezését. Általános szabály, hogy egy atom elektront elfogadva vagy adományozva, vagy közös elektronpárt alkotva hajlamos arra, hogy a külső elektronhéj konfigurációját a nemesgázokéhoz hasonló konfigurációba hozza. A szerves vegyületekre a következő típusú kémiai kötések jellemzőek: - ionos kötés - kovalens kötés - donor - akceptor kötés - hidrogénkötés. A kémiai kötéseknek néhány más fajtája is létezik (fémes, egyelektronos, kételektronos háromközpontú) , de a szerves vegyületekben gyakorlatilag nem találhatók meg. 20
A szerves vegyületek kötéstípusai A szerves vegyületekre a legjellemzőbb a kovalens kötés. A kovalens kötés az atomok kölcsönhatása, amely egy közös elektronpár kialakításával valósul meg. Ez a fajta kötés olyan atomok között jön létre, amelyek elektronegativitása összehasonlítható. Az elektronegativitás az atom azon tulajdonsága, amely azt mutatja, hogy képes magához vonzani az elektronokat más atomoktól. A kovalens kötés lehet poláris vagy nem poláris. Az azonos elektronegativitású atomok között nem poláris kovalens kötés jön létre
A szerves vegyületek kötéseinek típusai Különböző elektronegativitású atomok között poláris kovalens kötés jön létre. Ebben az esetben a kötött atomok parciális töltéseket vesznek fel δ+δ+ δ-δ- A kovalens kötés speciális altípusa a donor-akceptor kötés. A korábbi példákhoz hasonlóan ez a fajta kölcsönhatás egy közös elektronpár jelenlétének köszönhető, de ez utóbbit a kötést alkotó atomok egyike (donor) biztosítja, és egy másik atom (akceptor) fogadja el 24
A szerves vegyületek kötéseinek típusai Ionos kötés jön létre az elektronegativitás értékében nagymértékben eltérő atomok között. Ebben az esetben a kevésbé elektronegatív elemből (gyakran fémből) származó elektron teljesen átkerül a nagyobb elektronegatív elemre. Ez az elektronátmenet a kevésbé elektronegatív atomon pozitív, a nagyobb elektronegatív atomon negatív töltés megjelenését okozza. Így két ellentétes töltésű ion keletkezik, amelyek között elektrovalens kölcsönhatás lép fel. 25
A kötések típusai szerves vegyületekben A hidrogénkötés elektrosztatikus kölcsönhatás egy erősen poláris módon kötött hidrogénatom és oxigén, fluor, nitrogén, kén és klór elektronpárjai között. Ez a fajta interakció meglehetősen gyenge kölcsönhatás. A hidrogénkötés lehet intermolekuláris vagy intramolekuláris. Intermolekuláris hidrogénkötés (kölcsönhatás két etil-alkohol-molekula között) Intramolekuláris hidrogénkötés szalicilsav-aldehidben 26
Kémiai kötés szerves molekulákban A kémiai kötés modern elmélete a molekula, mint elektronokból és atommagokból álló rendszer kvantummechanikai modelljén alapul. A kvantummechanikai elmélet sarokköve az atompálya. Az atomi pálya a tér azon része, amelyben az elektronok megtalálásának valószínűsége maximális. A kötés tehát felfogható azon pályák kölcsönhatásának („átfedésének”), amelyek mindegyike egy elektront hordoz ellentétes spinekkel. 27
Atompályák hibridizációja A kvantummechanikai elmélet szerint az atom által létrehozott kovalens kötések számát az egyelektronos atomi pályák száma (a párosítatlan elektronok száma) határozza meg. A szénatomnak alapállapotában csak két párosítatlan elektronja van, de az elektron lehetséges átmenete 2s-ről 2 pz-re négy kovalens kötés kialakítását teszi lehetővé. A szénatomnak azt az állapotát, amelyben négy párosítatlan elektronja van, „gerjesztettnek” nevezzük. Annak ellenére, hogy a szénpályák egyenlőtlenek, ismert, hogy az atompályák hibridizációja miatt négy egyenértékű kötés kialakulása lehetséges. A hibridizáció olyan jelenség, amelyben több, különböző alakú és energiában hasonló pályából azonos számú, azonos alakú és számú pálya jön létre. 28
A szénatom hibrid állapotai szerves molekulákban ELSŐ HIBRID ÁLLAPOT A C atom sp 3 hibridizációs állapotban van, négy σ kötést képez, négy hibrid pályát alkot, amelyek tetraéder alakban helyezkednek el (kötésszög) σ kötés 31
A szénatom hibrid állapotai szerves molekulákban MÁSODIK HIBRID ÁLLAPOT A C atom sp 2 hibridizáció állapotában van, három σ-kötést képez, három hibrid pályát alkot, amelyek lapos háromszög alakban helyezkednek el (120 kötési szög) σ-kötések π-kötés 32
A szénatom hibrid állapotai szerves molekulákban HARMADIK HIBRID ÁLLAPOT A C atom sp-hibridizált állapotban van, két σ-kötést képez, két hibrid pályát alkot, amelyek egy vonalba rendeződnek (kötési szög 180) σ-kötések π - kötvények 33
A kémiai kötések jellemzői POLING skála: F-4,0; O – 3,5; Cl – 3,0; N – 3,0; Br – 2,8; S – 2,5; C-2,5; H-2.1. különbség 1.7 A kémiai kötések jellemzői A kötés polarizálhatósága az elektronsűrűség eltolódása külső tényezők hatására. A kötés polarizálhatósága az elektronok mozgékonyságának mértéke. Az atom sugarának növekedésével az elektronok polarizálhatósága nő. Ezért a szén-halogén kötés polarizálhatósága a következőképpen nő: C-F Elektronikus effektusok. Az atomok kölcsönös hatása egy molekulában 39 A modern elméleti felfogások szerint a szerves molekulák reakciókészségét előre meghatározza a kovalens kötést alkotó elektronfelhők elmozdulása és mobilitása. A szerves kémiában kétféle elektroneltolódást különböztetnek meg: a) a -bond rendszerben fellépő elektronelmozdulásokat, b) a -bond rendszer által közvetített elektronikus elmozdulásokat. Az első esetben az úgynevezett induktív hatás történik, a másodikban - mezomer hatás. Az induktív hatás az elektronsűrűség újraeloszlása (polarizáció), amely a kötésrendszerben lévő molekula atomjai közötti elektronegativitás különbségéből adódik. A -kötések jelentéktelen polarizálhatósága miatt az induktív hatás gyorsan elmúlik és 3-4 kötés után szinte fel sem tűnik.
Elektronikus effektusok. Az atomok kölcsönös hatása egy molekulában 40 Az induktív hatás fogalmát K. Ingold vezette be, és bevezette a következő elnevezéseket is: –I-hatás az elektronsűrűség csökkenése esetén szubsztituens +I-hatás az elektronsűrűség szubsztituens növekedésének esete Az alkilcsoportok (CH 3, C 2 H 5 - stb.) pozitív induktív hatást mutatnak. A szénatomhoz kapcsolódó összes többi szubsztituens negatív induktív hatást fejt ki.
Elektronikus effektusok. Az atomok kölcsönös hatása egy molekulában 41 A mezomer hatás az elektronsűrűség újraeloszlása egy konjugált rendszer mentén. A konjugált rendszerek közé tartoznak a szerves vegyületek molekulái, amelyekben kettős és egyszeres kötések váltakoznak, vagy ha a p-pályán egy magányos elektronpárral rendelkező atom található a kettős kötés mellett. Az első esetben - ragozás, a második esetben p, -ragozás történik. A csatolt rendszerek nyitott és zárt áramkörű konfigurációkban kaphatók. Ilyen vegyületek például az 1,3-butadién és a benzin. Ezeknek a vegyületeknek a molekuláiban a szénatomok sp 2 hibridizációs állapotban vannak, és a nem hibrid p-pályák miatt -kötéseket képeznek, amelyek egymást átfedik és egyetlen elektronfelhőt alkotnak, azaz konjugáció megy végbe.
Elektronikus effektusok. Az atomok kölcsönös hatása egy molekulában 42 A mezomer hatásnak két típusa van - pozitív mezomer hatás (+M) és negatív mezomer hatás (-M). Pozitív mezomer hatást mutatnak azok a szubsztituensek, amelyek p-elektronokat biztosítanak a konjugált rendszerhez. Ide tartoznak: -O, -S -NH 2, -OH, -OR, Hal (halogének) és más szubsztituensek, amelyek negatív töltéssel vagy magányos elektronpárral rendelkeznek. A negatív mezomer hatás azokra a szubsztituensekre jellemző, amelyek a konjugált rendszer elektronsűrűségét abszorbeálják. Ide tartoznak azok a szubsztituensek, amelyekben több kötés van az atomok között különböző elektronegativitással: - N0 2 ; -S03H; >C=O; -COON és mások. A mezomer hatást grafikusan egy hajlított nyíl tükrözi, amely az elektronok elmozdulásának irányát mutatja, az indukciós hatástól eltérően a mezomer hatás nem szűnik meg. Teljes mértékben az egész rendszerben továbbítódik, függetlenül az interfész lánc hosszától. C=O; -COON és mások. A mezomer hatást grafikusan egy hajlított nyíl tükrözi, amely az elektronok elmozdulásának irányát mutatja, az indukciós hatástól eltérően a mezomer hatás nem szűnik meg. Az interfészlánc hosszától függetlenül teljes egészében a rendszerben továbbítódik."> A kémiai reakciók típusai 43 A kémiai reakciót a reagens és a szubsztrát kölcsönhatásának tekinthetjük. A molekulákban a kémiai kötések felszakításának és kialakításának módjától függően a szerves reakciókat a következőkre osztjuk: a) homolitikus b) heterolitikus c) molekuláris A homolitikus vagy szabad gyökös reakciókat a kötés homolitikus hasadása okozza, amikor minden atomban egy elektron marad. , azaz gyökök keletkeznek . A homolitikus hasítás magas hőmérsékleten, fénykvantum hatására vagy katalízis hatására következik be.
A heterolitikus vagy ionos reakciók úgy mennek végbe, hogy az egyik atom közelében egy kötőelektronpár marad, és ionok keletkeznek. Az elektronpárral rendelkező részecskéket nukleofilnek nevezzük, és negatív töltésű (-). Az elektronpár nélküli részecskét elektrofilnek nevezzük, és pozitív töltésű (+). 44 A kémiai reakciók típusai
A kémiai reakció mechanizmusa 45 A reakció mechanizmusa az adott reakciót alkotó elemi (egyszerű) szakaszok összessége. A reakciómechanizmus leggyakrabban a következő szakaszokból áll: a reagens aktiválása elektrofil, nukleofil vagy szabad gyök képződésével. A reagens aktiválásához általában katalizátorra van szükség. A második szakaszban az aktivált reagens kölcsönhatásba lép a szubsztrátummal. Ebben az esetben közbenső részecskék (intermedierek) keletkeznek. Ez utóbbiak közé tartoznak a -komplexek, -komplexek (karbokationok), a karbanionok és az új szabad gyökök. Az utolsó szakaszban egy részecske hozzáadása vagy eltávolítása a második szakaszban képződött intermedierhez (abból) a reakció végtermékének képződésével történik. Ha egy reagens aktiválásakor nukleofilt hoz létre, akkor ezek nukleofil reakciók. N betűvel vannak jelölve (az indexben). Abban az esetben, ha a reagens elektrofilt hoz létre, a reakciókat elektrofilnek (E) kell besorolni. Ugyanez mondható el a szabad gyökös reakciókról (R).
A nukleofilek olyan reagensek, amelyek negatív töltéssel vagy elektronsűrűségben dús atommal rendelkeznek: 1) anionok: OH -, CN -, RO -, RS -, Hal - és egyéb anionok; 2) semleges molekulák magányos elektronpárokkal: NH 3, NH 2 R, H 2 O, ROH és mások; 3) túlzott elektronsűrűségű molekulák (kötésekkel). Az elektrofilek olyan reagensek, amelyek pozitív töltéssel vagy elektronsűrűségben kimerült atommal rendelkeznek: 1) kationok: H + (proton), HSO 3 + (hidrogén-szulfónium-ion), NO 2 + (nitrónium-ion), NO (nitrozónium-ion) és egyéb kationok; 2) üres pályával rendelkező semleges molekulák: AlCl 3, FeBr 3, SnCl 4, BF 4 (Lewis-savak), SO 3; 3) kimerült elektronsűrűségű molekulák az atomon. 46
49
50
51
52
Helló! Jelenleg sok orvostanhallgató tanul bioszerves kémiát, más néven biokémiát. Egyes egyetemeken ez a tárgy teszttel, máshol vizsgával zárul. Néha megtörténik, hogy az egyik egyetemen végzett vizsga nehézsége hasonló egy másik egyetemen végzett vizsgához. Egyetememen bioszerves kémiából vizsgáztak a nyári szekcióban, az első év legvégén. Azt kell mondanunk, hogy a BOC egyike azoknak a tárgyaknak, amelyek elsőre ijesztőek, és „ezt lehetetlen átadni” gondolatot ébresztheti. Ez természetesen különösen igaz azokra az emberekre, akiknek gyenge alapismeretük van a szerves kémiában (és furcsa módon az orvosi egyetemeken is van belőlük jó néhány). A bioszerves kémia tanulmányi programjai a különböző egyetemeken nagyon eltérőek lehetnek, és az oktatási módszerek még inkább eltérhetnek. A tanulókkal szemben támasztott követelmények azonban mindenhol megközelítőleg azonosak. Nagyon leegyszerűsítve, ahhoz, hogy a bioszerves kémiát 5-tel átadja, ismernie kell számos szerves anyag nevét, tulajdonságait, szerkezeti jellemzőit és jellemző reakcióit. Tanárunk, egy tekintélyes professzor úgy mutatta be az anyagot, mintha minden tanuló az iskola legjobb szerves kémia tanulója lenne (és a bioszerves kémia lényegében egy bonyolult iskolai szerves kémia tantárgy). Valószínűleg igaza volt a megközelítésében, mindenkinek törekednie kell a csúcsra, és a legjobb lenni. Ez azonban oda vezetett, hogy néhány hallgató, aki az első 2-3 órán részben nem értette a tananyagot, a félév közepére teljesen leállt. Nagyrészt azért döntöttem úgy, hogy megírom ezt az anyagot, mert még csak ilyen tanuló voltam. Az iskolában nagyon szerettem a szervetlen kémiát, de mindig is küszködtem a szerves anyagokkal. Már az egységes államvizsgára készülve azt a stratégiát választottam, hogy minden szervetlen tudásomat megerősítem, miközben csak az organikus bázist szilárdítom meg. Ez egyébként a belépési pontok tekintetében majdnem visszaütött rajtam, de ez egy másik történet. Nem hiába mondtam a tanítási módszertanról, mert a miénk is nagyon szokatlan volt. Rögtön, szinte az első órán megmutatták nekünk a kézikönyveket, amelyek szerint teszteket, majd vizsgát kellett tenni. A teljes tanfolyamunk 4 fő témára volt felosztva, amelyek mindegyike próbaórával zárult. Már mind a négy teszthez voltak kérdéseink az első pártól. Természetesen ijesztőek voltak, de ugyanakkor egyfajta térképként is szolgáltak, amelyen haladni lehetett. Az első teszt nagyon alap volt. Főleg a nómenklatúrának, a triviális (hétköznapi) és nemzetközi elnevezéseknek, és természetesen az anyagok osztályozásának szentelték. Valamint ilyen vagy olyan formában érintették az aromásság jeleit. Az első utáni második teszt sokkal nehezebbnek tűnt. Ott olyan anyagok tulajdonságait és reakcióit kellett leírni, mint a ketonok, aldehidek, alkoholok és karbonsavak. Például az aldehidek egyik legjellemzőbb reakciója az ezüsttükör reakció. Nagyon szép látvány. Ha Tollens-reagenst, azaz OH-t adunk bármilyen aldehidhez, akkor a kémcső falán tükörszerű csapadékot fog látni, így néz ki: A harmadik teszt a másodikhoz képest nem tűnt olyan félelmetesnek. Mindenki megszokta már, hogy a besorolások szerint írja le a reakciókat és emlékezzen a tulajdonságokra. A harmadik tesztben két funkciós csoportot tartalmazó vegyületekről beszéltünk - aminofenolokról, aminoalkoholokról, oxosavakról és másokról. Ezenkívül minden jegy tartalmazott legalább egy szénhidrátról szóló jegyet. A bioszerves kémia negyedik tesztje szinte teljes egészében fehérjéknek, aminosavaknak és peptidkötéseknek volt szentelve. Külön kiemelést jelentett az RNS és DNS gyűjtését igénylő kérdések. Egyébként pontosan így néz ki egy aminosav - látható az aminocsoport (ezen a képen sárgára van színezve) és a karbonsavcsoport (lila). Az ebbe az osztályba tartozó anyagokkal kellett megküzdenünk a negyedik tesztben. Minden tesztet a táblán vettek fel - a hallgatónak felszólítás nélkül le kell írnia és el kell magyaráznia az összes szükséges tulajdonságot reakciók formájában. Például, ha a második tesztet végzi, akkor az alkoholok tulajdonságai szerepelnek a jegyében. A tanár azt mondja: vegyen be propanolt. Leírod a propanol képletét és 4-5 tipikus reakcióját, hogy szemléltetd a tulajdonságait. Lehetnek egzotikus dolgok is, például kéntartalmú vegyületek. Egy hiba még az egyik reakciótermék indexében is gyakran tovább küldött, hogy tanulmányozzam ezt az anyagot a következő próbálkozásig (ami egy héttel később volt). Ijedős? Durva? Biztosan! Ennek a megközelítésnek azonban van egy nagyon kellemes mellékhatása. Nehéz volt a szokásos szemináriumi órák alatt. Sokan 5-6 alkalommal vettek részt a teszteken. De a vizsga nagyon könnyű volt, mert minden jegy 4 kérdést tartalmazott. Pontosan, mindegyik már megtanult és megoldott tesztből egyet. Ezért nem is fogom leírni a bioszerves kémia vizsgára való felkészülés bonyodalmait. Esetünkben minden felkészülés azon múlott, hogyan készültünk fel magukra a tesztekre. Magabiztosan teljesítettem mind a négy tesztet - a vizsga előtt csak nézze át a saját piszkozatait, írja le a legalapvetőbb reakciókat, és minden azonnal helyreáll. A tény az, hogy a szerves kémia nagyon logikus tudomány. Amire emlékezned kell, az nem a reakciók hatalmas sorozata, hanem maguk a mechanizmusok. Igen, megjegyzem, hogy ez nem működik minden elemnél. Nem fog tudni átmenni a félelmetes anatómián, ha egyszerűen elolvassa előző napi jegyzeteit. Számos más elemnek is megvan a maga sajátossága. Még akkor is, ha az orvosi egyetemen másképp tanítják a bioszerves kémiát, előfordulhat, hogy módosítania kell a felkészülését, és egy kicsit másképp kell csinálnia, mint én. Mindenesetre sok sikert neked, értsd és szeresd a tudományt!



























































































Bioszerves kémia - tesztek és vizsga