Nf3 valentligi va oksidlanish darajasi. Eng muhim azotli birikmalar
Vazifa 1. Birikmalarning mustahkamligi ketma-ketlikda qanday o'zgarishini aniqlang: HF, HCl, HBr, HI.
Yechim. Ushbu diatomik molekulalar uchun bog'lanish kuchi bog'lanish uzunligiga bog'liq. Va ftordan yodga o'tishda atom radiusi ortib borayotganligi sababli, bu yo'nalishdagi H-halogen aloqasining uzunligi ortadi, ya'ni. ftordan yodga o'tganda birikmalarning kuchi kamayadi.
Vazifa 2. Quyidagi molekulalar va ionlar nechta elektron va protondan iborat: a) AlH 4 - ; b) NF 3?
Yechim
a) Element atomidagi protonlar soni elementning atom raqamiga teng, shuning uchun alyuminiy atomida 13 proton, vodorod atomida bitta proton mavjud. Hammasi bo'lib ion 17 ta protonni o'z ichiga oladi. Ionning zaryadi -1 ga teng, shuning uchun elektronlar soni protonlar sonidan bittaga ko'p va 18 ga teng.
b) azot atomida 7 proton, ftor atomida 9 proton bor. Hammasi bo'lib NF 3 molekulasida 7 + 3 9 = 34 proton mavjud. Molekulaning zaryadi 0 ga teng, shuning uchun elektronlar soni protonlar soniga teng.
Javob. a) 17 proton, 18 elektron; b) 34 proton, 34 elektron.
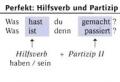
Vazifa 3. Azotning valentligi va oksidlanish darajasi qanday: a) nitrat kislotada; b) ammoniy xloridda?
Yechim.
a) Nitrat kislotaning tuzilish formulasi ba'zan besh valentli azot bilan quyidagicha tasvirlangan:
O // H - O - N \\ O
Haqiqatda, besh valentli azot mavjud emas, chunki buning uchun azot atomida beshta juftlashtirilmagan elektron bo'lishi kerak.
Azot 2s elektronlarining juftlashishi juda katta energiya sarfini talab qiladi va amalda sodir bo'lmaydi. Nitrat kislota tarkibidagi azot atomi IV valentlikka ega. Uchta N-O kovalent bog'lanish juftlashtirilmagan elektronlar hisobiga, bittasi esa azot elektronlarining yolg'iz juftligi tufayli hosil bo'ladi. Nitrat kislotaning tuzilish formulasini quyidagicha yozish mumkin:
O/H-O-N\\O
bu erda o'q donor-akseptor aloqasini ko'rsatadi. Vodorodning oksidlanish darajasi +1, kislorod -2, molekuladagi atomlarning oksidlanish darajalari yig'indisi 0 ga teng, shuning uchun azot atomining an'anaviy zaryadi +5 ga teng.
b) Iondagi azotning valentligi IV ga teng. Uchta N-H kovalent bog'lanish azotning juftlanmagan elektronlari tufayli, bittasi esa yolg'iz elektron juftligi tufayli hosil bo'ladi.
Vodorodning oksidlanish darajasi +1, iondagi atomlarning oksidlanish darajalari yig'indisi ionning zaryadiga (-1) teng, shuning uchun azot atomining an'anaviy zaryadi -3 ga teng.
Javob. a) valentlik IV, oksidlanish darajasi +5. b) valentlik IV, oksidlanish darajasi -3.
Vazifa 4. Quyidagi birikmalardagi elementlarning oksidlanish darajalarini aniqlang: K 2 MnO 4; Ba(ClO 3) 2; F 2 O; Ca(NO 2) 2; H 2 SiF 6; H2O2; Cr 2 (SO 4) 3 .
Yechim. Oksidlanish darajalarini aniqlashda quyidagi qoidalardan foydalanamiz: 1) molekuladagi atomlarning oksidlanish darajalari yig’indisi 0 ga teng; 2) metalmaslar bilan birikmalarda H ning oksidlanish darajasi +1 ga teng; 3) O ning oksidlanish darajasi -2 ga teng, ftor va peroksid birikmalaridan tashqari; 4) ftor F ning oksidlanish darajasi -1; 5) metallning oksidlanish darajasi metall ionining zaryadiga teng. Ushbu qoidalardan foydalanib, biz quyidagilarni topamiz:
1) K 2 MnO 4: K +1, Mn +6, O -2;
2) Ba(ClO 3) 2: Ba +2, Cl +5, O -2;
3) F 2 O: F -1, O +2;
4) Ca(NO 2) 2: Ca +2, N +3, O -2;
5) H 2 SiF 2: H +1, Si +4, F -1;
6) H 2 O 2: H +1, O -1;
7) Cr 2 (SO 4) 3: Cr +3, S +6, O -2.
Vazifa 5. 3-aminobenzoy kislotaning tuzilish formulasini keltiring. Kimyoviy bog'lanishlarning tabiatini, elementlarning valentligini va oksidlanish darajasini ko'rsating.
Yechim. 3-aminobenzoy kislotasi molekulasidagi barcha aloqalar qutbli kovalentdir, benzol halqasidagi CC aloqalaridan tashqari, qutbsiz kovalent:
Elementlarning valentliklari: C - IV, O - II, H - I, N - III. Oksidlanish darajasi: H +1, O -2, N -3. Uglerod atomlarining oksidlanish darajalari har xil. C-H bog'langan benzol halqasidagi C atomlarining oksidlanish darajasi -1 ga (chunki uglerod vodorodga qaraganda ko'proq elektron manfiy element), C-N aloqasi bo'lgan C atomining oksidlanish darajasi +1 ga (azot uglerodga qaraganda ko'proq elektronegativdir) ), C-C bog'dagi C atomi - oksidlanish darajasi 0 (bir xil atomlar orasidagi bog'lanish). Nihoyat, COOH guruhidagi C atomi ko'proq elektronegativ O atomlari bilan uchta bog' bilan bog'langan va oksidlanish darajasi +3 ga teng.
Azot- davriy sistemaning V A-guruhining 2-davr elementi, tartib raqami 7. Atomning elektron formulasi [ 2 He]2s 2 2p 3, xarakterli oksidlanish darajalari 0, -3, +3 va +5, kamroq. ko'pincha +2 va +4 va boshqa holat N v nisbatan barqaror hisoblanadi.
Azot uchun oksidlanish darajalari shkalasi:
+5 - N 2 O 5, NO 3, NaNO 3, AgNO 3
3 – N 2 O 3, NO 2, HNO 2, NaNO 2, NF 3
3 - NH 3, NH 4, NH 3 * H 2 O, NH 2 Cl, Li 3 N, Cl 3 N.
Azot yuqori elektromanfiylikka ega (3.07), F va O dan keyin uchinchi oʻrinda turadi. U tipik metall boʻlmagan (kislotali) xossalarni namoyon qiladi, turli kislorodli kislotalar, tuzlar va ikkilik birikmalar, shuningdek, ammoniy kationi NH 4 va uning tuzlarini hosil qiladi.
Tabiatda - o'n ettinchi kimyoviy ko'p element bo'yicha (metall bo'lmaganlar orasida to'qqizinchi). Barcha organizmlar uchun muhim element.
N 2
Oddiy modda. U juda barqaror ˚sp-bog'i N≡N bo'lgan qutbsiz molekulalardan iborat bo'lib, bu oddiy sharoitda elementning kimyoviy inertligini tushuntiradi.
Rangsiz, ta'msiz va hidsiz gaz, rangsiz suyuqlikka aylanadi (O2 dan farqli o'laroq).
Havoning asosiy komponenti hajmi bo'yicha 78,09%, massa bo'yicha 75,52 ni tashkil qiladi. Azot kisloroddan oldin suyuq havodan qaynab ketadi. Suvda ozgina eriydi (20 ˚C da 15,4 ml/1 l H 2 O), azotning eruvchanligi kislorodnikidan kamroq.
Xona haroratida N2 ftor bilan va juda oz miqdorda kislorod bilan reaksiyaga kirishadi:
N 2 + 3F 2 = 2NF 3, N 2 + O 2 ↔ 2NO
Ammiak ishlab chiqarish uchun qaytariladigan reaktsiya 200˚C haroratda, 350 atm gacha bosim ostida va har doim katalizator (Fe, F 2 O 3, FeO, Pt bilan laboratoriyada) ishtirokida sodir bo'ladi.
N 2 + 3H 2 ↔ 2NH 3 + 92 kJ
Le Chatelier printsipiga ko'ra, ammiak hosildorligining oshishi bosimning oshishi va haroratning pasayishi bilan sodir bo'lishi kerak. Biroq, past haroratlarda reaksiya tezligi juda past, shuning uchun jarayon 450-500 ˚C da olib boriladi, ammiakning 15% hosiliga erishiladi. Reaksiyaga kirmagan N 2 va H 2 reaktorga qaytariladi va shu bilan reaksiya darajasini oshiradi.
Azot kislotalar va ishqorlarga nisbatan kimyoviy jihatdan passiv bo'lib, yonishni qo'llab-quvvatlamaydi.
Kvitansiya V sanoat– suyuq havoni fraksiyonel distillash yoki havodan kislorodni kimyoviy vositalar bilan olib tashlash, masalan, qizdirilganda 2C (koks) + O 2 = 2CO reaktsiyasi bilan. Bunday hollarda azot olinadi, unda asil gazlarning (asosan argon) aralashmalari ham mavjud.
Laboratoriyada oz miqdorda kimyoviy toza azotni o'rtacha isitish bilan kommutatsiya reaktsiyasi orqali olish mumkin:
N -3 H 4 N 3 O 2(T) = N 2 0 + 2H 2 O (60-70)
NH 4 Cl(p) + KNO 2 (p) = N 2 0 + KCl + 2H 2 O (100˚C)
Ammiak sintezi uchun ishlatiladi. Kimyoviy va metallurgiya jarayonlari va yonuvchan moddalarni saqlash uchun inert vosita sifatida azot kislotasi va boshqa azot o'z ichiga olgan mahsulotlar.
N.H. 3
Ikkilik birikma, azotning oksidlanish darajasi – 3. Oʻtkir xarakterli hidli rangsiz gaz. Molekula to'liq bo'lmagan tetraedrning tuzilishiga ega [: N(H) 3 ] (sp 3 gibridlanish). NH 3 molekulasidagi azotning sp 3 gibrid orbitalida donor juft elektronlar mavjudligi vodorod kationini qo'shishning xarakterli reaktsiyasini aniqlaydi, bu esa kation hosil bo'lishiga olib keladi. ammoniy NH4. Xona haroratida ortiqcha bosim ostida suyultiriladi. Suyuq holatda u vodorod aloqalari orqali bog'lanadi. Termal jihatdan beqaror. Suvda yaxshi eriydi (20˚C da 700 l/1 l H 2 O dan ortiq); to'yingan eritmadagi ulush og'irligi bo'yicha 34% va hajm bo'yicha 99%, pH = 11,8.
Juda reaktiv, qo'shilish reaktsiyalariga moyil. Kislorodda yonadi, kislotalar bilan reaksiyaga kirishadi. U qaytaruvchi (N -3 tufayli) va oksidlovchi (H +1 tufayli) xossalarini namoyon qiladi. U faqat kaltsiy oksidi bilan quritiladi.
Sifatli reaktsiyalar - gazsimon HCl bilan aloqa qilganda oq "tutun" hosil bo'lishi, Hg 2 (NO3) 2 eritmasi bilan namlangan qog'oz parchasining qorayishi.
HNO 3 va ammoniy tuzlari sintezidagi oraliq mahsulot. Soda, azotli o'g'itlar, bo'yoqlar, portlovchi moddalar ishlab chiqarishda qo'llaniladi; suyuq ammiak sovutgichdir. Zaharli.
Eng muhim reaksiyalar tenglamalari:
2NH 3 (g) ↔ N 2 + 3H 2
NH 3 (g) + H 2 O ↔ NH 3 * H 2 O (p) ↔ NH 4 + + OH —
NH 3 (g) + HCl (g) ↔ NH 4 Cl (g) oq “tutun”
4NH 3 + 3O 2 (havo) = 2N 2 + 6 H 2 O (yonish)
4NH 3 + 5O 2 = 4NO+ 6 H 2 O (800˚C, kat. Pt/Rh)
2 NH 3 + 3CuO = 3Cu + N 2 + 3 H 2 O (500˚C)
2 NH 3 + 3Mg = Mg 3 N 2 +3 H 2 (600 ˚C)
NH 3 (g) + CO 2 (g) + H 2 O = NH 4 HCO 3 (xona harorati, bosim)
Kvitansiya. IN laboratoriyalar– sodali ohak bilan qizdirilganda ammiakning ammoniy tuzlaridan siljishi: Ca(OH) 2 + 2NH 4 Cl = CaCl 2 + 2H 2 O + NH 3
Yoki ammiakning suvli eritmasini qaynatib, keyin gazni quriting.
Sanoatda Ammiak azot va vodoroddan ishlab chiqariladi. Sanoat tomonidan suyultirilgan shaklda yoki texnik nom ostida konsentrlangan suvli eritma shaklida ishlab chiqariladi. ammiakli suv.

Ammiak gidratiN.H. 3
*
H 2
O.
Molekulyar aloqa. Oq, kristall panjarada - zaif vodorod aloqasi bilan bog'langan NH 3 va H 2 O molekulalari. Ammiakning suvli eritmasida zaif asos (dissosiatsiya mahsulotlari - NH 4 kation va OH anioni) mavjud. Ammoniy kationi muntazam tetraedral tuzilishga ega (sp 3 gibridlanishi). Termik jihatdan beqaror, eritma qaynatilganda butunlay parchalanadi. Kuchli kislotalar bilan neytrallanadi. Konsentrlangan eritmada kamaytiruvchi xususiyatlarni (N-3 tufayli) ko'rsatadi. U ion almashinish va kompleks hosil qilish reaksiyalariga uchraydi.
Sifatli reaktsiya- gazsimon HCl bilan aloqa qilganda oq "tutun" hosil bo'lishi. Amfoter gidroksidlarni cho'ktirish paytida eritmada ozgina ishqoriy muhit yaratish uchun ishlatiladi.
1 M ammiak eritmasi asosan NH 3 *H 2 O gidrat va faqat 0,4% NH 4 OH ionlarini o'z ichiga oladi (gidrat dissotsiatsiyasi tufayli); Shunday qilib, ionli "ammiak gidroksid NH 4 OH" deyarli eritmada mavjud emas va qattiq gidratda bunday birikma yo'q.
Eng muhim reaksiyalar tenglamalari:
NH 3 H 2 O (kons.) = NH 3 + H 2 O (NaOH bilan qaynash)
NH 3 H 2 O + HCl (suyultirilgan) = NH 4 Cl + H 2 O
3(NH 3 H 2 O) (konc.) + CrCl 3 = Cr(OH) 3 ↓ + 3 NH 4 Cl
8(NH 3 H 2 O) (konk.) + 3Br 2(p) = N 2 + 6 NH 4 Br + 8H 2 O (40-50˚C)
2(NH 3 H 2 O) (konk.) + 2KMnO 4 = N 2 + 2MnO 2 ↓ + 4H 2 O + 2KOH
4(NH 3 H 2 O) (konk.) + Ag 2 O = 2OH + 3H 2 O
4(NH 3 H 2 O) (kons.) + Cu(OH) 2 + (OH) 2 + 4H 2 O
6(NH 3 H 2 O) (konc.) + NiCl 2 = Cl 2 + 6H 2 O
Ko'pincha suyultirilgan ammiak eritmasi (3-10%) deyiladi ammiak(nomi alkimyogarlar tomonidan ixtiro qilingan) va konsentrlangan eritma (18,5 - 25%) ammiak eritmasi (sanoat tomonidan ishlab chiqarilgan).
Azot oksidlari
Azot oksidiYO'Q
Tuz hosil qilmaydigan oksid. Rangsiz gaz. Radikal tarkibida kovalent s-bog' (Ngam O), qattiq holatda N-N bog'li N 2 O 2 dimer mavjud. Termik jihatdan juda barqaror. Havo kislorodiga sezgir (jigarrang). Suvda ozgina eriydi va u bilan reaksiyaga kirishmaydi. Kimyoviy jihatdan kislotalar va ishqorlarga nisbatan passiv. Qizdirilganda u metallar va metall bo'lmaganlar bilan reaksiyaga kirishadi. NO va NO 2 ning yuqori reaktiv aralashmasi ("azotli gazlar"). Nitrat kislota sintezidagi oraliq mahsulot.
Eng muhim reaksiyalar tenglamalari:
2NO + O 2 (g) = 2NO 2 (20˚C)
2NO + C (grafit) = N 2 + CO 2 (400-500˚C)
10NO + 4P(qizil) = 5N 2 + 2P 2 O 5 (150-200˚C)
2NO + 4Cu = N 2 + 2 Cu 2 O (500-600˚C)
NO va NO 2 aralashmalariga reaktsiyalar:
NO + NO 2 +H 2 O = 2HNO 2 (p)
NO + NO 2 + 2KOH(dil.) = 2KNO 2 + H 2 O
NO + NO 2 + Na 2 CO 3 = 2Na 2 NO 2 + CO 2 (450-500˚C)
Kvitansiya V sanoat: katalizatorda ammiakning kislorod bilan oksidlanishi, in laboratoriyalar- suyultirilgan nitrat kislotaning qaytaruvchi moddalar bilan o'zaro ta'siri:
8HNO 3 + 6Hg = 3Hg 2 (NO 3) 2 + 2 YO'Q+ 4 H 2 O
yoki nitratning kamayishi:
2NaNO 2 + 2H 2 SO 4 + 2NaI = 2 YO'Q +
I 2 ↓ + 2 H 2 O + 2Na 2 SO 4
Azot dioksidiYO'Q 2
Kislota oksidi shartli ravishda ikkita kislotaga mos keladi - HNO 2 va HNO 3 (N 4 uchun kislota mavjud emas). Jigarrang gaz, xona haroratida monomer NO 2, sovuqda suyuq rangsiz dimer N 2 O 4 (dianitrogen tetroksidi). Suv va gidroksidi bilan to'liq reaksiyaga kirishadi. Metalllarning korroziyasini keltirib chiqaradigan juda kuchli oksidlovchi vosita. U nitrat kislota va suvsiz nitratlarni sintez qilish uchun, raketa yoqilg'isini oksidlovchi, oltingugurtdan yog'ni tozalash va organik birikmalarni oksidlash uchun katalizator sifatida ishlatiladi. Zaharli.
Eng muhim reaksiyalar tenglamasi:
2NO 2 ↔ 2NO + O 2
4NO 2 (l) + H 2 O = 2HNO 3 + N 2 O 3 (sin.) (sovuqda)
3 NO 2 + H 2 O = 3HNO 3 + NO
2NO 2 + 2NaOH (suyultirilgan) = NaNO 2 + NaNO 3 + H 2 O
4NO 2 + O 2 + 2 H 2 O = 4 HNO 3
4NO 2 + O 2 + KOH = KNO 3 + 2 H 2 O
2NO 2 + 7H 2 = 2NH 3 + 4 H 2 O (kat. Pt, Ni)
NO 2 + 2HI(p) = NO + I 2 ↓ + H 2 O
NO 2 + H 2 O + SO 2 = H 2 SO 4 + NO (50-60˚C)
NO 2 + K = KNO 2
6NO 2 + Bi(NO 3) 3 + 3NO (70-110˚C)
Kvitansiya: V sanoat - NO ning atmosfera kislorodi bilan oksidlanishi, in laboratoriyalar- konsentrlangan nitrat kislotaning qaytaruvchi moddalar bilan o'zaro ta'siri:
6HNO 3 (kons., hor.) + S = H 2 SO 4 + 6NO 2 + 2H 2 O
5HNO 3 (konk., hor.) + P (qizil) = H 3 PO 4 + 5NO 2 + H 2 O
2HNO 3 (kons., hor.) + SO 2 = H 2 SO 4 + 2 NO 2
Dianitrogen oksidiN 2 O
Yoqimli hidli rangsiz gaz ("kuluvchi gaz"), Nga NgamO, azotning rasmiy oksidlanish darajasi +1, suvda yomon eriydi. Grafit va magniyning yonishini qo'llab-quvvatlaydi:
2N 2 O + C = CO 2 + 2N 2 (450˚C)
N 2 O + Mg = N 2 + MgO (500˚C)
Ammiakli selitraning termik parchalanishi natijasida olinadi:
NH 4 NO 3 = N 2 O + 2 H 2 O (195-245˚C)
tibbiyotda anestetik sifatida ishlatiladi.
Dianitrogen trioksidN 2 O 3
Past haroratlarda - ko'k rangli suyuqlik, ONga NO 2, azotning rasmiy oksidlanish darajasi +3. 20 ˚C da u 90% rangsiz NO va jigarrang NO 2 aralashmasiga parchalanadi ("azotli gazlar", sanoat tutuni - "tulki dumi"). N 2 O 3 kislotali oksid, sovuqda suv bilan HNO 2 hosil qiladi, qizdirilganda u boshqacha reaksiyaga kirishadi:
3N 2 O 3 + H 2 O = 2HNO 3 + 4NO
Ishqorlar bilan u HNO 2 tuzlarini beradi, masalan, NaNO 2.
NO ni O 2 (4NO + 3O 2 = 2N 2 O 3) yoki NO 2 (NO 2 + NO = N 2 O 3) bilan reaksiyaga kiritish orqali olinadi.
kuchli sovutish bilan. "Azotli gazlar" ham ekologik jihatdan xavfli bo'lib, atmosferaning ozon qatlamini yo'q qilish uchun katalizator vazifasini bajaradi.
Dianitrogen pentoksidi N 2 O 5
Rangsiz, qattiq modda, O 2 N – O – NO 2, azotning oksidlanish darajasi +5. Xona haroratida 10 soat ichida NO 2 va O 2 ga parchalanadi. Suv va ishqorlar bilan kislota oksidi sifatida reaksiyaga kirishadi:
N2O5 + H2O = 2HNO3
N 2 O 5 + 2NaOH = 2NaNO 3 + H 2
Tuzli nitrat kislotani suvsizlantirish orqali tayyorlanadi:
2HNO3 + P2O5 = N2O5 + 2HPO3
yoki -78˚C da NO 2 ning ozon bilan oksidlanishi:
2NO 2 + O 3 = N 2 O 5 + O 2
Nitritlar va nitratlar
Kaliy nitritKNO 2
. Oq, gigroskopik. Parchalanmasdan eriydi. Quruq havoda barqaror. Suvda juda eriydi (rangsiz eritma hosil qiladi), anionda gidrolizlanadi. Kislotali muhitda odatiy oksidlovchi va qaytaruvchi vosita, ishqoriy muhitda juda sekin reaksiyaga kirishadi. Ion almashinish reaksiyalariga kiradi. Sifatli reaksiyalar NO 2 ionida - binafsha rangli MnO 4 eritmasining rangi o'zgarishi va I ionlarini qo'shganda qora cho'kma paydo bo'lishi.U bo'yoqlar ishlab chiqarishda, aminokislotalar va yodidlar uchun analitik reagent va fotoreagentlarning tarkibiy qismi sifatida ishlatiladi. .
Eng muhim reaksiyalar tenglamasi:
2KNO 2 (t) + 2HNO 3 (konk.) = NO 2 + NO + H 2 O + 2KNO 3
2KNO 2 (dil.)+ O 2 (masalan) → 2KNO 3 (60-80 ˚C)
KNO 2 + H 2 O + Br 2 = KNO 3 + 2HBr
5NO 2 - + 6H + + 2MnO 4 - (viol.) = 5NO 3 - + 2Mn 2+ (bts.) + 3H 2 O
3 NO 2 - + 8H + + CrO 7 2- = 3NO 3 - + 2Cr 3+ + 4H 2 O
NO 2 - (to'yingan) + NH 4 + (to'yingan) = N 2 + 2H 2 O
2NO 2 - + 4H + + 2I - (bts.) = 2NO + I 2 (qora) ↓ = 2H 2 O
NO 2 - (suyultirilgan) + Ag + = AgNO 2 (och sariq)↓
Kvitansiya Vsanoat- jarayonlarda kaliy nitratining kamayishi:
KNO3 + Pb = KNO 2+ PbO (350-400˚C)
KNO 3 (konc.) + Pb (shimgich) + H 2 O = KNO 2+ Pb(OH) 2 ↓
3 KNO3 + CaO + SO2 = 2 KNO 2+ CaSO 4 (300 ˚C)
H
itrat
kaliy
KNO 3
Texnik nomi kaliy, yoki hind tuz , selitra. Oq, parchalanmasdan eriydi va keyingi qizdirilganda parchalanadi. Havoda barqaror. Suvda yaxshi eriydi (yuqori endo-effekt, = -36 kJ), gidroliz yo'q. Birlashish vaqtida kuchli oksidlovchi vosita (atom kislorodining chiqishi tufayli). Eritmada faqat atom vodorod bilan qaytariladi (kislotali muhitda KNO 2 ga, ishqoriy muhitda NH 3 ga). U shisha ishlab chiqarishda, oziq-ovqat konservanti, pirotexnika aralashmalari va mineral o'g'itlarning tarkibiy qismi sifatida ishlatiladi.
2KNO 3 = 2KNO 2 + O 2 (400-500 ˚C)
KNO 3 + 2H 0 (Zn, dil. HCl) = KNO 2 + H 2 O
KNO 3 + 8H 0 (Al, kon. KOH) = NH 3 + 2H 2 O + KOH (80 ˚C)
KNO 3 + NH 4 Cl = N 2 O + 2H 2 O + KCl (230-300 ˚C)
2 KNO 3 + 3C (grafit) + S = N 2 + 3CO 2 + K 2 S (yonish)
KNO 3 + Pb = KNO 2 + PbO (350 - 400 ˚C)
KNO 3 + 2KOH + MnO 2 = K 2 MnO 4 + KNO 2 + H 2 O (350 - 400 ˚C)
Kvitansiya: sanoatda
4KOH (hor.) + 4NO 2 + O 2 = 4KNO 3 + 2H 2 O
va laboratoriyada:
KCl + AgNO 3 = KNO 3 + AgCl↓

Azot, ehtimol, butun Quyosh tizimidagi eng keng tarqalgan kimyoviy elementdir. Aniqroq aytganda, azot ko'pligi bo'yicha 4-o'rinni egallaydi. Tabiatdagi azot inert gazdir.
Bu gazning rangi ham, hidi ham yo'q va suvda eriydigan juda qiyin. Biroq, nitrat tuzlari suv bilan juda yaxshi reaksiyaga kirishadi. Azot past zichlikka ega.
Azot ajoyib elementdir. Taxminlarga ko'ra, u o'z nomini qadimgi yunon tilidan olgan bo'lib, undan tarjima qilingan "jonsiz, buzilgan" degan ma'noni anglatadi. Nega azotga nisbatan bunday salbiy munosabat? Axir, biz bilamizki, u oqsillarning bir qismidir va usiz nafas olish deyarli mumkin emas. Azot tabiatda muhim rol o'ynaydi. Ammo atmosferada bu gaz inertdir. Agar siz uni asl shaklida qabul qilsangiz, unda ko'plab yon ta'sirlar mumkin. Jabrlanuvchi hatto bo'g'ilishdan o'lishi mumkin. Axir, azot jonsiz deb ataladi, chunki u yonishni ham, nafas olishni ham qo'llab-quvvatlamaydi.

Oddiy sharoitlarda bunday gaz faqat lityum bilan reaksiyaga kirishib, lityum nitridi Li3N kabi birikma hosil qiladi. Ko'rib turganimizdek, bunday birikmadagi azotning oksidlanish darajasi -3 ga teng. Albatta, u boshqa metallar bilan ham reaksiyaga kirishadi, lekin faqat qizdirilganda yoki turli katalizatorlardan foydalanganda. Aytgancha, -3 azotning eng past oksidlanish darajasidir, chunki tashqi energiya darajasini to'liq to'ldirish uchun faqat 3 ta elektron kerak bo'ladi.
Ushbu ko'rsatkich turli xil ma'nolarga ega. Azotning har bir oksidlanish darajasi o'ziga xos birikmaga ega. Bunday aloqalarni oddiygina eslab qolish yaxshiroqdir.
5 - azotning eng yuqori oksidlanish darajasi. Barcha nitrat tuzlarida uchraydi.
Azotning birikmalardagi oksidlanish darajalari -3, -2, -1, 0, +1, +2, +3, +4, +5.
-3 oksidlanish holatidagi azotli birikmalar nitridlar bilan ifodalanadi, ulardan ammiak amalda eng muhimi hisoblanadi;
-2 oksidlanish holatidagi azotli birikmalar kamroq xarakterlidir va pernitridlar bilan ifodalanadi, ulardan eng muhimi vodorod pernitridi N2H4 yoki gidrazindir (shuningdek, o'ta beqaror vodorod pernitridi N2H2, diimid ham mavjud);
Oksidlanish holatidagi azotli birikmalar -1 NH2OH (gidroksilamin) organik sintezda gidroksilammoniy tuzlari bilan birga ishlatiladigan beqaror asosdir;
Oksidlanish holatidagi azotli birikmalar +1 azot oksidi (I) N2O (azot oksidi, kuluvchi gaz);
Oksidlanish holatidagi azotli birikmalar +2 azot oksidi (II) NO (azot oksidi);
Oksidlanish darajasidagi azotli birikmalar +3 azot oksidi (III) N2O3, azot kislotasi, NO2− anion hosilalari, azot triftorid (NF3);
Oksidlanish holatidagi azotli birikmalar +4 azot oksidi (IV) NO2 (azot dioksidi, jigarrang gaz);
Oksidlanish holatidagi azotli birikmalar +5 azot oksidi (V) N2O5, nitrat kislota, uning tuzlari - nitratlar va boshqa hosilalar, shuningdek tetraflorammoniy NF4+ va uning tuzlari.
Ammiak azot va vodorodning birikmasidir. Kimyo sanoatida muhim ahamiyatga ega. Ammiakning formulasi NH 3 dir.
Xarakterli o'tkir hidli rangsiz gaz. Ammiak havodan ancha yengil, bu gazning bir litrining massasi 0,77 g.Vodorod aloqalari tufayli ammiak anormal darajada yuqori qaynash nuqtasiga ega, bu uning past molekulyar og'irligiga to'g'ri kelmaydi, suvda yaxshi eriydi.
Ammoniy tuzlari. Ammoniy tuzlarining aksariyati rangsiz va suvda yaxshi eriydi. Ba'zi xususiyatlarda ular gidroksidi metallarning tuzlariga, ayniqsa kaliyga o'xshaydi. Ammoniy tuzlari termal jihatdan beqaror. Ular qizdirilganda parchalanadi. Bu parchalanish teskari yoki qaytarib bo'lmaydigan tarzda sodir bo'lishi mumkin.
Ammoniy tuzlari keng qo'llaniladi. Ularning ko'p qismi (ammiak sulfat, ammiakli selitra) o'g'it sifatida ishlatiladi. Ammoniy xlorid yoki ammiak bo'yash va to'qimachilik sanoatida, lehimlash va qalaylashda, galvanik elementlarda qo'llaniladi.
Nitrat kislota kuchli monobazik kislotadir. Suyultirilgan eritmalarda H +1 va NO -1 3 ionlariga butunlay parchalanadi.
Sof nitrat kislota o'tkir hidli rangsiz suyuqlikdir. 86 ° C da qaynatiladi. Gigroskopik. Yorug'lik ta'sirida u asta-sekin parchalanadi.
Nitrat kislota kuchli oksidlovchi moddadir. Ko'pgina metall bo'lmaganlar osongina oksidlanadi va kislotalarga aylanadi.
Nitrat kislota oltin, platina, tantal, rodyum va iridiydan tashqari deyarli barcha metallarga ta'sir qiladi. Konsentrlangan nitrat kislota ba'zi metallarning (temir, alyuminiy, xrom) passiv bo'lishiga olib keladi. Azot kislotadagi azotning oksidlanish darajasi +5 ga teng. HNO 3 kontsentratsiyasi qanchalik yuqori bo'lsa, shunchalik chuqurroq kamayadi. Konsentrlangan nitrat kislota bilan reaksiyalar odatda NO 2 ni chiqaradi. Suyultirilgan nitrat kislota mis kabi kam faol metallar bilan reaksiyaga kirishganda NO ajralib chiqadi.
Ilova. U ko'p miqdorda azotli o'g'itlar, bo'yoqlar, portlovchi moddalar va dori-darmonlarni ishlab chiqarish uchun ishlatiladi. Nitrat kislota azotli usulda sulfat kislota olishda ishlatiladi va tsellyuloza laklari va plyonka ishlab chiqarish uchun ishlatiladi.
Nitrat kislota tuzlari. Monobazik nitrat kislota faqat o'rta tuzlarni hosil qiladi, ular nitratlar deb ataladi. Barcha nitratlar suvda yaxshi eriydi va qizdirilganda ular parchalanib, kislorodni chiqaradi.
Standart elektrod potentsiallari qatorida magniyning chap tomonida joylashgan eng faol metallarning nitratlari nitritlarga aylanadi.
Nitrat kislota tuzlari ichida eng muhimi natriy, kaliy, ammoniy va kaltsiy nitratlar bo'lib, ular amalda nitrat deb ataladi. Nitr asosan o'g'it sifatida ishlatiladi.
Azotli o'g'itlar Ammoniy nitrat (ammiakli selitra) Bu azotga boy eng samarali o'g'itdir. Nitrat va ammiak holida 33-35% azot bor. Suvda oson eriydi, ko'p tuproqlarda yaxshi ishlaydi ammoniy sulfat Taxminan 21% azotni o'z ichiga oladi. Bu rangsiz, rombsimon kristalldir. Bu o'g'it ammiakli selitraga qaraganda kamroq gigroskopikdir, qotib qolmaydi va yonmaydi Karbamid Bu azotli eng qimmatli o'g'itdir. Karbamid o'simliklar tomonidan oson so'riladigan shaklda eng katta miqdordagi azotni (taxminan 46%) o'z ichiga oladi. U rangsiz yoki sarg'ish kristallar shaklida ko'rinadi va suvda juda eriydi. Karbamid portlovchi emas, ozgina gigroskopik va keks qilmaydi Kaliy nitrat (kaliy nitrat) Kaliy nitrat tarkibida azotga qaraganda taxminan 3 baravar ko'p kaliy mavjud. Shuning uchun u boshqa oʻgʻitlar bilan birgalikda qoʻllaniladi.Kalsiy nitrat (Norvegiya selitrasi) Qimmatbaho azotli oʻgʻit. Taxminan 13% azot o'z ichiga oladi Ammoniy xlorid Oq kukun, taxminan 25% azotni o'z ichiga oladi