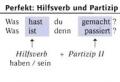
Bioorganik kimyo. Bioorganik kimyo fanining predmeti
Bioorganik kimyo fanining predmeti.Organiklarning tuzilishi va izomeriyasi
ulanishlar.
Kimyoviy bog'lanish va o'zaro ta'sir
organik birikmalardagi atomlar.
Kimyoviy reaksiyalar turlari.
Poli- va geterofunksional
ulanishlar.
Asosiy darslik - Tyukavkina N.A., Baukov Yu.I.
Bioorganik kimyo.
Ma’ruza va o‘quv qo‘llanma matni “Bioorganik kimyo
savol-javoblar” TDU veb-saytiga qarang http://tgumed.ru
"Talabalarga yordam" yorlig'i, "Ma'ruzalar bo'yicha
o‘quv rejasidagi fanlar”. Va, albatta, VK
Bioorganik kimyo hayot jarayonlarida ishtirok etuvchi moddalarning tuzilishi va xossalarini ularning biologik bilimlari bilan bog‘liq holda o‘rganadi.
Bioorganik kimyo moddalarning tuzilishi va xossalarini o'rganadibilan bog'liq holda, hayotiy jarayonlarda ishtirok etish
ularning biologik funktsiyalarini bilish.
Asosiy tadqiqot ob'ektlari biologik hisoblanadi
polimerlar (biopolimerlar) va bioregulyatorlar.
Biopolimerlar
–
yuqori molekulyar og'irlik
tabiiy
barcha tirik mavjudotlarning strukturaviy asosi bo'lgan birikmalar
organizmlar va jarayonlarda ma'lum rol o'ynaydi
hayotiy faoliyat. Biopolimerlarga peptidlar va
oqsillar, polisaxaridlar (uglevodlar), nuklein kislotalar. IN
Ushbu guruhga lipidlar ham kiradi, ular o'zlari emas
yuqori molekulyar birikmalardir, lekin ichida
tana odatda boshqa biopolimerlar bilan bog'lanadi.
Bioregulyatorlar kimyoviy ta'sir ko'rsatadigan birikmalardir
metabolizmni tartibga soladi. Bularga vitaminlar,
gormonlar, ko'plab sintetik biologik faol
birikmalar, shu jumladan dorilar.
Organizmda sodir bo'ladigan kimyoviy reaktsiyalar to'plamiga metabolizm yoki metabolizm deyiladi. Hujayralarda hosil bo'ladigan moddalar
Organizmda sodir bo'ladigan kimyoviy reaktsiyalar to'plamimetabolizm yoki metabolizm deb ataladi. Moddalar
o'simlik va hayvonlarning hujayralari, to'qimalari va organlarida hosil bo'ladi
metabolizm jarayonida metabolitlar deyiladi.
Metabolizm ikki yo'nalishni o'z ichiga oladi - katabolizm va
anabolizm.
Katabolizm deganda kiruvchi moddalarning parchalanish reaksiyalari tushuniladi
tanaga ovqat bilan. Qoida tariqasida, ular organik birikmalarning oksidlanishi bilan birga keladi va ularni chiqarish bilan davom etadi
energiya.
Anabolizm - murakkab molekulalarning sintezi
oddiyroq bo'lganlar, bu esa tirik organizmning strukturaviy elementlarining shakllanishi va yangilanishiga olib keladi.
Metabolik jarayonlar fermentlar ishtirokida sodir bo'ladi,
bular. hujayralarda mavjud bo'lgan o'ziga xos oqsillar
organizm va biokimyoviy katalizator rolini o'ynaydi
jarayonlar (biokatalizatorlar).
Metabolizm
katabolizmanabolizm
Biopolimerlarning parchalanishi
ta'kidlash bilan
energiya
Biopolimerlarning sintezi
so'rilishi bilan
energiya
Glitserin va
yog 'kislotasi
Organik birikmalar tuzilishi nazariyasining asosiy tamoyillari A.M. Butlerov
1. Molekuladagi atomlar ma'lum bir joyda joylashganularning valentligiga ko'ra ketma-ketliklar.
Organik moddalardagi uglerod atomining valentligi
ulanishlar to'rtga teng.
2. Moddalarning xossalari faqat nimaga bog'liq
atomlar va ular qanday miqdorda tarkibga kiradi
molekulalar, balki ular joylashgan tartibda ham
bir-biriga bog'langan.
3. Atomlar yoki atomlar guruhini tashkil etuvchi
molekulalar bir-biriga ta'sir qiladi, sabab bo'ladi
kimyoviy faollik va reaktsiyaga bog'liq
molekulalarning qobiliyati.
4. Moddalarning xossalarini o'rganish ularni aniqlash imkonini beradi
kimyoviy tuzilishi.
H o m o l o g h i c y r a y d
Gomologikqator
Bir qator strukturaviy o'xshash birikmalar mavjud
o'xshash kimyoviy xossalari, qaysi individual
qator a'zolari bir-biridan faqat miqdori bilan farqlanadi
guruhlar -CH2- homologik qator va guruh deyiladi
CH2 - homologik farq.
Har qanday homolog seriyaning a'zolari juda ko'p
Aksariyat reaksiyalar xuddi shunday davom etadi (istisno
faqat seriyaning birinchi a'zolarini tashkil qiladi). Shuning uchun, bilish
qatorning faqat bitta a'zosining kimyoviy reaktsiyalari, bu bilan mumkin
xuddi shunday deb ta'kidlashning yuqori ehtimoli bilan
o'zgarishlar turi qolgan a'zolar bilan ham sodir bo'ladi
gomologik qator.
Har qanday gomologik qatorni olish mumkin
atomlar orasidagi munosabatlarni aks ettiruvchi umumiy formula
ushbu seriyaning a'zolarida uglerod va vodorod; bu formula
gomologik qatorning umumiy formulasi deyiladi.
Organik birikmalarning uglerod skeletining tuzilishiga ko'ra tasnifi
Organik birikmalarning funktsional guruhlar mavjudligiga ko'ra tasnifi
Funktsional guruhSinf
Misol
halogen atomlari (F, Cl, Br, I) halogen hosilalari CH3CH2Cl (xloroetan)
gidroksil (-OH)
spirtlar (fenollar)
CH3CH2OH (etanol)
tiol yoki merkapto- (- tiollar (merkaptanlar) CH3CH2SH (etanetiol)
SN)
efir (–O–)
efirlar
CH3CH2–O–CH2CH3
(dietil
efir)
efir
karboksil-C BMT
efirlar
CH3CH2COOCH3 (metil asetat)
karboksilik kislotalar CH3COOH (sirka kislotasi)
amid –S ONN2
amidlar
karbonil (–C=O)
sulfo- (-SO3H)
amino- (-NH2)
aldegidlar va
ketonlar
sulfonik kislotalar
aminlar
nitro- (-NO2)
nitro birikmalari
kislotalar
CH3CONH2 (asetamid)
CH3CHO (etanal)
CH3COCH3 (propanon)
SN3SO3N (metansülfonik kislota)
CH3CH2NH2
(etilamin,
asosiy amin)
CH3NHCH3
(dimetilamin,
ikkilamchi amin)
CH3CH2NO2 (nitroetan)
Organik birikmalarning nomenklaturasi
Organik birikmalarning izomeriyasi
Ikki yoki undan ortiq alohida moddalar mavjud bo'lsabir xil miqdoriy tarkib (molekulyar formula),
lekin bir-biridan bog`lanish ketma-ketligi bilan farqlanadi
atomlar va (yoki) ularning kosmosdagi joylashuvi, keyin esa umuman
Bunday holda ular izomerlar deb ataladi.
Ushbu birikmalarning tuzilishi boshqacha bo'lganligi sababli
izomerlarning kimyoviy yoki fizik xossalari
har xil.
Izomeriya turlari: strukturaviy (tuzilma izomerlari) va
stereoizomerizm (fazoviy).
Strukturaviy izomeriya uch xil bo'lishi mumkin:
- uglerod skeletining izomeriyasi (zanjir izomerlari),
- pozitsiya izomerlari (bir nechta bog'lanish yoki funktsional
guruhlar),
- funksional guruhning izomerlari (sinflararo).
Stereoizomerizm bir necha bo'linadi
konfiguratsiya
yoqilgan
konformatsion
Va
Bu geometrik izomeriya
Samolyot polarizatsiyalangan yorug'lik
Optik faollik belgilari:- assimetrik uglerod atomining mavjudligi;
- molekulyar simmetriya elementlarining yo'qligi
Adrenalinning enantiomerlari
oqsil
Anion
Yassi
markaz
sirt
ishg'ol qilinmagan
Yassi
Anion
sirt
markaz
band
(+) - adrenalin
(-) - adrenalin
to'liqsiz
yozishmalar
past
faoliyat
to'liq
yozishmalar
yuqori
faoliyat
Enantiomerlarning biologik faolligi
asparaginDARVON
analjezik
NOVRAD
antitussiv dori
oyna
L-asparagin
D-asparagin
(qushqo'nmasdan)
(no'xatdan)
achchiq ta'mi
shirin ta'mi
enantiomerlar
Talidomid qurbonlari
Organik birikmalarning kislotaliligi va asosligi
Bronsted kislotalar (protik kislotalar) -mumkin bo'lgan neytral molekulalar yoki ionlar
proton berish (proton donorlari).
Odatda Bronsted kislotalari karboksilik kislotalardir
kislotalar. Ular zaif kislotali xususiyatlarga ega
fenollar va spirtlarning gidroksil guruhlari, shuningdek tio-,
amino va imino guruhlari.
Bronsted asoslar neytral molekulalar yoki
protonni qabul qilishga qodir ionlar (akseptorlar
protonlar).
Odatda Bronsted asoslari aminlardir.
Amfolitlar - birikmalar, molekulalarda
tarkibida ham kislotali, ham
asosiy guruhlar.
Bronsted bo'yicha kislotalar va asoslar turlari
Novokain molekulasidagi asosiy markazlar
Dori vositalarining suvda eruvchan shakllarini olish uchun asosiy xususiyatlardan foydalanish
Asosiyxususiyatlari
dorivor
dorilar
Ularning suvda eruvchan shakllarini olish uchun ishlatiladi.
Kislotalar bilan o'zaro ta'sirlashganda, birikmalar bilan
ionli bog'lar - suvda yaxshi eriydigan tuzlar.
Ha, in'ektsiya uchun novokain
gidroxlorid shaklida qo'llaniladi.
eng kuchli asosiy markaz,
proton qo'shilgan
Moddalarning kislota-asos xossalari va ularning organizmga kirishi
lipidmembrana
Oshqozon pH 1
UNS
lipid
membrana
qon plazmasi
pH 7,4
UNS
OSOSN3
Oshqozon pH 1
+
OSOSN3
NH3
SOOOOSCH3
SOO-
NH2
NH2
OSOSN3
Ichak pH 7-8
qon plazmasi
pH 7,4
Ichak pH 7-8
Kislotali dorilar oshqozondan yaxshiroq so'riladi (pH 1-3),
va dorilar yoki ksenobiotik asoslarning so'rilishi faqat sodir bo'ladi
ular oshqozondan ichakka o'tgandan keyin (pH 7-8). Davomida
Bir soat ichida atsetilsalitsil kislotasining deyarli 60% kalamushlarning oshqozonidan so'riladi.
kislota va yuborilgan dozaning atigi 6% anilin. Sichqonlarning ichaklarida
Anilinning qabul qilingan dozasining 56% allaqachon so'riladi. Bunday zaif poydevor
kofein kabi (rKVH + 0,8), bir vaqtning o'zida ancha ko'proq so'riladi
daraja (36%), chunki oshqozonning yuqori kislotali muhitida ham kofein
asosan ionlashtirilmagan holatda bo'ladi.
Organik kimyoda reaksiyalar turlari
Organik reaktsiyalar quyidagilarga ko'ra tasniflanadiquyidagi belgilar:
1. Reaktivlarning elektron tabiatiga ko'ra.
2. Reaksiya jarayonida zarrachalar sonining o'zgarishi bilan.
3. O'ziga xos xususiyatlar asosida.
4. Elementar mexanizmlarga ko'ra
reaktsiyalar bosqichlari.
Reagentlarning elektron tabiatiga ko'ra reaktsiyalar ajralib turadi: nukleofil, elektrofil va erkin radikal
Erkin radikallar elektr neytral zarralardirjuftlashtirilmagan elektronga ega bo'lish, masalan: Cl, NO2.
Erkin radikal reaksiyalar alkanlarga xosdir.
Elektrofil reagentlar kationlar yoki molekulalardir
o'z-o'zidan yoki katalizator ishtirokida
elektron juft yoki uchun ortib yaqinlik bor
molekulalarning manfiy zaryadlangan markazlari. Bularga kiradi
H+, Cl+, +NO2, +SO3H, R+ kationlari va erkin molekulalar
orbitallar AlCl3, ZnCl2 va boshqalar.
Elektrofil reaktsiyalar alkenlarga, alkinlarga,
aromatik birikmalar (qo'sh bog'lanishda qo'shilish,
proton almashinuvi).
Nukleofil reagentlar anionlar yoki molekulalardir
elektron zichligi oshgan markazlarga ega. Ularga
kabi anionlar va molekulalar kiradi
HO-, RO-, Cl-, Br-, RCOO-, CN-, R-, NH3, C2H5OH va boshqalar. O'zgartirish bo'yicha
davomida zarrachalar soni
reaksiyalar ajralib turadi
almashtirish reaktsiyalari,
qo'shilishlar,
ajratish
(yo'q qilish),
parchalanish
Reaksiyalarning ma'lum xususiyatlariga ko'ra tasnifi
Reaktivlik har doim hisobga olinadi
faqat reaktsion sherikga nisbatan.
Kimyoviy transformatsiya paytida, odatda
butun molekula ta'sir qilmaydi, lekin uning faqat bir qismi -
reaktsiya markazi.
Organik birikma o'z ichiga olishi mumkin
bir nechta teng bo'lmagan reaktsiya markazlari.
Reaksiyalar izomerik mahsulotlarga olib kelishi mumkin.
Reaktsiyaning selektivligi - sifatli
xarakterli ma'no ustunlik qiladi
dan reaksiya bir yo'nalishda boradi
bir nechta mumkin.
Regioselektivlik mavjud,
xemoselektivlik, reaksiyaning stereoselektivligi.
Organik kimyoda reaksiyalarning selektivligi
Regioselektivlik - bo'yicha imtiyozli reaktsiyamolekulaning bir nechta reaksiya markazlaridan biri.
CH3-CH2-CH3 + Br2
SN3-SNVr-SN3 + NVr
Ikkinchi izomer 1-bromopropan amalda hosil bo'lmaydi.
Kimyoselektivlik - bo'yicha imtiyozli reaktsiya
tegishli funktsional guruhlardan biri.
Stereoselektivlik - reaktsiyada imtiyozli shakllanish
bir nechta mumkin bo'lgan stereoizomerlardan biri. Ko'p funktsiyali birikmalar o'z ichiga oladi
bir nechta bir xil funktsional guruhlar.
Geterofunksional birikmalar tarkibiga kiradi
turli xil funktsional guruhlar.
Geteropolifunksional
birikmalar ikkalasini ham o'z ichiga oladi
har xil va bir xil
funktsional guruhlar.
Poli- va geterofunksional birikmalarning xossalari
Har bir guruh poli- va geterofunksionalbirikmalar bilan bir xil reaksiyalarga kirishishi mumkin
monofunksionalda tegishli guruh
ulanishlar Poli- va o'ziga xos xususiyatlari
heterofunksional birikmalar
Tsiklizatsiya reaktsiyalari
Xelat komplekslarining hosil bo'lishi Antidotlar sifatida ko'p funktsiyali birikmalar
Og'ir metallarning toksik ta'siri
oqsillarning tiol guruhlarini bog'lash. Natijada, ular inhibe qilinadi
tananing hayotiy fermentlari.
Antidotlarning ta'sir qilish printsipi kuchli shakllanishdir
og'ir metallar ionlari bilan komplekslar.
Zamonaviy bioorganik kimyo tarmoqlangan bilim sohasi boʻlib, koʻplab biotibbiyot fanlari va birinchi navbatda biokimyo, molekulyar biologiya, genomika, proteomika va
bioinformatika, immunologiya, farmakologiya.
Dastur butun kursni yagona nazariy asosda qurish uchun tizimli yondashuvga asoslanadi.
organikning elektron va fazoviy tuzilishi haqidagi g'oyalarga asoslangan
birikmalar va ularning kimyoviy o'zgarishlar mexanizmlari. Material 5 bo'lim shaklida taqdim etilgan bo'lib, ulardan eng muhimlari: "Organik birikmalar tuzilishining nazariy asoslari va ularning reaktivligini belgilovchi omillar", "Organik birikmalarning biologik muhim sinflari" va "Biopolimerlar va ularning tarkibiy qismlari. Lipidlar"
Dastur tibbiyot universitetida bioorganik kimyoni maxsus o'qitishga qaratilgan va shuning uchun fan "tibbiyotda bioorganik kimyo" deb nomlanadi. Bioorganik kimyoni o'qitishni profillash tibbiyot va kimyoning rivojlanishi o'rtasidagi tarixiy bog'liqlikni, shu jumladan organik, biologik muhim organik birikmalar (geterofunktsional birikmalar, geterosikllar, uglevodlar, aminokislotalar va oqsillar, nukleinlar) sinflariga e'tiborni kuchaytirish orqali xizmat qiladi. kislotalar, lipidlar), shuningdek, ushbu birikmalar sinflarining biologik muhim reaktsiyalari ). Dasturning alohida bo'limi organik birikmalarning ma'lum sinflarining farmakologik xususiyatlarini va ayrim dori vositalarining kimyoviy tabiatini ko'rib chiqishga bag'ishlangan.
Zamonaviy inson kasalliklari tarkibida "oksidlovchi stress kasalliklari" ning muhim rolini hisobga olgan holda, dastur erkin radikal oksidlanish reaktsiyalariga, laboratoriya diagnostikasida erkin radikal lipid oksidlanishining yakuniy mahsulotlarini aniqlashga, tabiiy antioksidantlar va antioksidant preparatlarga alohida e'tibor beradi. Dastur ekologik muammolarni, ya'ni ksenobiotiklarning tabiatini va ularning tirik organizmlarga toksik ta'sir qilish mexanizmlarini ko'rib chiqishni nazarda tutadi.
1. Treningning maqsadi va vazifalari.
1.1. Tibbiyotda bioorganik kimyo fanini o‘qitishdan maqsad bioorganik kimyoning zamonaviy biologiyaning asosi sifatidagi o‘rni, bioorganik birikmalarning biologik ta’sirini tushuntirishning nazariy asoslari, dori vositalarining ta’sir qilish mexanizmlari va ularning yaratilishi to‘g‘risida tushunchalarni shakllantirishdan iborat. yangi dorilar. Bioorganik birikmalarning eng muhim sinflarining tuzilishi, kimyoviy xossalari va biologik faolligi o'rtasidagi bog'liqlik haqidagi bilimlarni rivojlantirish, olingan bilimlarni keyingi fanlarni o'rganishda va kasbiy faoliyatda qo'llash usullarini o'rgatish.
1.2.Bioorganik kimyo o’qitishning vazifalari:
1. Bioorganik birikmalarning tibbiy va biologik ahamiyatini belgilovchi eng muhim sinflarining tuzilishi, xossalari va reaksiya mexanizmlari haqida bilimlarni shakllantirish.
2. Organik birikmalarning kimyoviy xossalari va biologik faolligini tushuntirish uchun asos sifatida ularning elektron va fazoviy tuzilishi haqidagi tasavvurlarni shakllantirish.
3. Ko'nikma va amaliy ko'nikmalarni shakllantirish:
bioorganik birikmalarni uglerod skeletining tuzilishi va funksional guruhlariga ko‘ra tasniflash;
metabolitlar, dori vositalari, ksenobiotiklar nomlarini ko‘rsatishda kimyoviy nomenklatura qoidalaridan foydalanish;
molekulalardagi reaksiya markazlarini aniqlash;
klinik va laboratoriya ahamiyatiga ega bo'lgan sifatli reaksiyalarni amalga oshira olish.
2. OOP tuzilmasida intizomning o‘rni:
“Bioorganik kimyo” fani “Kimyo” fanining ajralmas qismi bo‘lib, fanlarning matematika, tabiatshunoslik sikliga kiradi.
Fanni o'rganish uchun zarur bo'lgan asosiy bilimlar matematika, tabiatshunoslik fanlari siklida shakllanadi: fizika, matematika; tibbiy informatika; kimyo; biologiya; anatomiya, gistologiya, embriologiya, sitologiya; normal fiziologiya; mikrobiologiya, virusologiya.
Bu fanlarni o'rganish uchun zaruriy shart:
biokimyo;
farmakologiya;
mikrobiologiya, virusologiya;
immunologiya;
kasbiy fanlar.
O'quv rejasining asosiy qismi doirasida fanlararo aloqalarni ta'minlovchi parallel ravishda o'rganiladigan fanlar:
kimyo, fizika, biologiya, 3. Bioorganik kimyoni o‘rganish uchun talabalar o‘zlashtirishlari kerak bo‘lgan fanlar va mavzular ro‘yxati.
Umumiy kimyo. Atomning tuzilishi, kimyoviy bog ning tabiati, bog lanish turlari, kimyoviy moddalar sinflari, reaksiya turlari, kataliz, suvli eritmalardagi muhit reaksiyasi.
Organik kimyo. Organik moddalar sinflari, organik birikmalar nomenklaturasi, uglerod atomining konfiguratsiyasi, atom orbitallarining qutblanishi, sigma va pi bog'lari. Organik birikmalar sinflarining genetik aloqasi. Turli sinfdagi organik birikmalarning reaktivligi.
Fizika. Atomning tuzilishi. Optika - spektrning ultrabinafsha, ko'rinadigan va infraqizil hududlari.
Yorug'likning materiya bilan o'zaro ta'siri - uzatish, yutilish, aks ettirish, tarqalish. Polarizatsiyalangan yorug'lik.
Biologiya. Genetik kod. Irsiyat va o'zgaruvchanlikning kimyoviy asoslari.
Lotin tili. Terminologiyani o'zlashtirish.
Xorijiy til. Xorijiy adabiyotlar bilan ishlash qobiliyati.
4. Intizom bo'limlari va fanlararo bog'lanishlar bilan (keyingi) fanlar No Ushbu fanning taqdim etilganlarni o'rganish uchun zarur bo'lgan bo'limlari No. Berilgan kichik fanlarning nomi (keyingi) fanlar (keyingi) fanlar 1 2 3 4 5 1 Kimyo + + + + + Biologiya + - - + + Biokimyo + + + + + + 4 Mikrobiologiya, virusologiya + + - + + + 5 Immunologiya + - - - + Farmakologiya + + - + + + 7 Gigiena + - + + + Kasbiy fanlar + - - + + + 5. Savdo darajasiga qo'yiladigan talablar. fan mazmunini o`zlashtirish O`quv maqsadiga erishish “Bioorganik kimyo” fani bir qancha maqsadli muammoli vazifalarni amalga oshirishni o`z ichiga oladi, buning natijasida talabalarda ma`lum malaka, bilim, ko`nikmalar hosil bo`lishi, muayyan amaliy ko`nikmalarga ega bo`lishi kerak.
5.1. Talaba quyidagilarga ega bo'lishi kerak:
5.1.1. Umumiy madaniy vakolatlar:
ijtimoiy ahamiyatga ega muammolar va jarayonlarni tahlil qilish, turli xil kasbiy va ijtimoiy faoliyat turlarida gumanitar, tabiiy fanlar, biotibbiyot va klinik fanlar usullaridan amaliyotda foydalanish qobiliyati va tayyorligi (OK-1);
5.1.2. Professional kompetensiyalar (PC):
ilmiy va kasbiy ma'lumotlarni olish, saqlash, qayta ishlashning asosiy usullari, usullari va vositalarini qo'llash qobiliyati va tayyorligi; turli manbalardan ma'lumot olish, shu jumladan zamonaviy kompyuter vositalaridan, tarmoq texnologiyalaridan, ma'lumotlar bazalaridan foydalanish va ilmiy adabiyotlar bilan ishlash, ma'lumotlarni tahlil qilish, qidirish, o'qiganingizni professional muammolarni hal qilish vositasiga aylantirish qobiliyati va tayyorligi (asosiy narsani ajratib ko'rsatish). qoidalar, ulardan kelib chiqadigan oqibatlar va takliflar);
ilmiy muammolarni belgilash va ularni eksperimental amalga oshirishda ishtirok etish qobiliyati va tayyorligi (PC-2, PC-3, PC-5, PC-7).
5.2. Talaba bilishi kerak:
Organik birikmalarning tasnifi, nomenklaturasi va izomeriyasi tamoyillari.
Organik birikmalarning tuzilishi va reaksiyaga kirishish qobiliyatini o’rganish uchun asos bo’lgan nazariy organik kimyo asoslari.
Organik molekulalarning fazoviy va elektron tuzilishi va ularning biologik tuzilishi, kimyoviy xossalari va biologik muhim organik birikmalarning asosiy sinflarining biologik roli bilan bevosita bog'liq holda hayot jarayonlarining ishtirokchilari bo'lgan moddalarning kimyoviy o'zgarishi.
5.3. Talaba quyidagilarni bilishi kerak:
Organik birikmalarni uglerod skeletining tuzilishi va funksional guruhlar tabiatiga ko‘ra tasniflang.
Biologik ahamiyatga ega moddalar va dorilarning strukturaviy formulasi bo'yicha tipik vakillarini nomlari va nomlari bo'yicha formulalar tuzing.
Organik birikmalarning kimyoviy harakatlarini aniqlash uchun molekulalardagi funktsional guruhlarni, kislotali va asosiy markazlarni, konjugatsiyalangan va aromatik bo'laklarni aniqlang.
Organik birikmalarning kimyoviy o'zgarishlar yo'nalishi va natijasini bashorat qilish.
5.4. Talaba quyidagilarga ega bo'lishi kerak:
O'quv, ilmiy va ma'lumotnoma adabiyotlari bilan mustaqil ishlash ko'nikmalari; qidiruv o'tkazish va umumiy xulosalar chiqarish.
Kimyoviy shisha idishlar bilan ishlash ko'nikmalariga ega bo'lish.
Kimyoviy laboratoriyada xavfsiz ishlash va gidroksidi, zaharli, yuqori uchuvchi organik birikmalar bilan ishlash, yondirgichlar, spirtli lampalar va elektr isitish moslamalari bilan ishlash ko'nikmalariga ega bo'lish.
5.5. Bilimlarni nazorat qilish shakllari 5.5.1. Joriy nazorat:
Materiallarni assimilyatsiya qilishning diagnostik nazorati. U davriy ravishda, asosan, formulalar bo'yicha bilimlarni nazorat qilish uchun amalga oshiriladi.
Har bir darsda o'quv kompyuter nazorati.
Tahlil qilish va umumlashtirish qobiliyatini talab qiluvchi test topshiriqlari (Ilovaga qarang).
Dasturning katta bo'limlarini o'rganish tugagandan so'ng rejalashtirilgan kollokviumlar (Ilovaga qarang).
5.5.2 Yakuniy nazorat:
Sinov (ikki bosqichda o'tkaziladi):
C.2 - Matematik, tabiiy va tibbiy-biologik Umumiy mehnat intensivligi:
2 Organik zamonaviy fizik birikmalarning tasnifi, nomenklaturasi va tasnifi va tasnifi xususiyatlari: uglerod skeletining tuzilishi va funktsional guruhning tabiati.
kimyoviy usullar Funksional guruhlar, organik radikallar. Organik birikmalarning bioorganik sinflari: spirtlar, fenollar, tiollar, efirlar, sulfidlar, aldegid birikmalari, ketonlar, karboksilik kislotalar va ularning hosilalari, sulfonik kislotalarning biologik muhim tadqiqotlari.
IUPAC nomenklaturasi. Xalqaro nomenklaturaning turlari: o'rnini bosuvchi va radikal-funksional nomenklatura. Bilimning qadri 3 Organik birikmalar tuzilishining nazariy asoslari va A.M.Butlerovning organik birikmalar tuzilishi nazariyasi. Ularning pozitsiyalarini belgilovchi asosiy omillar. Strukturaviy formulalar. Uglerod atomining joylashuvi va reaktivligi bo'yicha tabiati. zanjirlar. Izomeriya organik kimyoning o'ziga xos hodisasi sifatida. Stereoizomeriya turlari.
Optik izomeriya sababi sifatida organik birikmalar molekulalarining xiralligi. Bir xirallik markaziga ega bo'lgan molekulalarning stereoizomeriyasi (enantiomerizm). Optik faoliyat. Glitseraldegid konfiguratsiya standarti sifatida. Fisher proyeksiya formulalari. D va L Stereokimyoviy nomenklatura tizimi. R, S-nomenklaturasi haqidagi fikrlar.
Ikki yoki undan ortiq chirallik markazlari bo'lgan molekulalarning stereoizomeriyasi: enantiomerizm va diastereomerizm.
Qo'sh bog'li birikmalar seriyasida stereoizomerizm (Pydiastereomerizm). Cis va trans izomerlari. Stereoizomeriya va organik birikmalarning biologik faolligi.
Atomlarning o'zaro ta'siri: paydo bo'lish sabablari, turlari va organik birikmalar molekulalarida o'tish usullari.
Ulanish. Ochiq kontaktlarning zanglashiga olib ulanishi (Pi-Pi). Konjugatsiyalangan aloqalar. Biologik muhim birikmalardagi dien tuzilmalari: 1,3-dienlar (butadien), polienlar, alfa, beta-to'yinmagan karbonil birikmalari, karboksil guruhi. Birlashtirish tizimni barqarorlashtirish omili sifatida. Konjugatsiya energiyasi. Arenalarda (Pi-Pi) va geterosikllarda (p-Pi) konjugatsiya.
Xushbo'ylik. Aromatiklik mezonlari. Benzenoid (benzol, naftalin, antrasen, fenantren) va geterosiklik (furan, tiofen, pirrol, imidazol, piridin, pirimidin, purin) birikmalarining aromatikligi. Biologik muhim molekulalarda (porfin, gem va boshqalar) konjugatsiyalangan tuzilmalarning keng tarqalganligi.
Molekuladagi elektron zichligi notekis taqsimlanishining sababi sifatida bog'lanish polarizatsiyasi va elektron effektlar (induktiv va mezomer). Substituentlar elektron donorlar va elektron qabul qiluvchilardir.
Eng muhim o'rinbosarlar va ularning elektron effektlari. O'rinbosarlarning elektron ta'siri va molekulalarning reaktivligi. Benzol halqasida orientatsiya qoidasi, birinchi va ikkinchi turdagi o'rinbosarlar.
Organik birikmalarning kislotaliligi va asosligi.
Tarkibida vodorod boʻlgan funksional guruhlar (aminlar, spirtlar, tiollar, fenollar, karboksilik kislotalar) boʻlgan organik birikmalarning neytral molekulalarining kislotaligi va asosligi. Bronsted-Lowry va Lyuis bo'yicha kislotalar va asoslar. Kislotalar va asoslarning konjugat juftlari. Anion kislotaliligi va barqarorligi. Ka va pKa qiymatlari asosida organik birikmalarning kislotaliligini miqdoriy baholash.
Har xil sinfdagi organik birikmalarning kislotaligi. Organik birikmalarning kislotaliligini belgilovchi omillar: nometall atomning elektr manfiyligi (C-H, N-H va O-H kislotalar); metall bo'lmagan atomning polarizatsiyasi (spirtli ichimliklar va tiollar, tiol zaharlari); radikalning tabiati (spirtlar, fenollar, karboksilik kislotalar).
Organik birikmalarning asoslari. n-asoslar (geterotsikllar) va pi-asoslar (alkenlar, alkandienlar, arenlar). Organik birikmalarning asosligini belgilovchi omillar: geteroatomning elektr manfiyligi (O- va N asoslar); metall bo'lmagan atomning polarizatsiyasi (O- va S-asos); radikalning tabiati (alifatik va aromatik aminlar).
Neytral organik molekulalarning kislota-ishqor xossalarining ularning reaktivligi va biologik faolligi uchun ahamiyati.
Vodorod bog'lanishi kislota-asos xususiyatlarining o'ziga xos ko'rinishi sifatida. Organik birikmalarning reaktivligining umumiy qonuniyatlari ularning biologik faoliyatining kimyoviy asosi sifatida.
Organik birikmalarning reaksiya mexanizmlari.
Organik birikmalar reaksiyalarining almashinish, qo'shilish, yo'q qilish, qayta tashkil etish, oksidlanish-qaytarilish natijasi bo'yicha va mexanizmiga ko'ra - radikal, ionli (elektrofil, nukleofil) reaksiyalarining tasnifi. Organik birikmalardagi kovalent bog‘lanishning parchalanish turlari va hosil bo‘ladigan zarrachalar: gomolitik parchalanish (erkin radikallar) va geterolitik bo‘linish (karbokationlar va karbonanionlar).
Bu zarrachalarning elektron va fazoviy tuzilishi va ularning nisbiy barqarorligini belgilovchi omillar.
sp 3-gibridlangan uglerod atomining C-H aloqalarini o'z ichiga olgan alkanlarda gomolitik radikal almashtirish reaktsiyalari. Tirik hujayradagi erkin radikal oksidlanish reaksiyalari. Kislorodning reaktiv (radikal) shakllari. Antioksidantlar. Biologik ahamiyati.
Elektrofil qo'shilish reaktsiyalari (Ae): Pi bog'i ishtirokidagi geterolitik reaktsiyalar. Etilenni galogenlash va gidratlanish reaksiyalari mexanizmi. Kislota katalizi. Reaksiyalarning regioselektivligiga statik va dinamik omillarning ta'siri. Nosimmetrik alkenlarda vodorodli moddalarni Pi bog`iga qo`shilish reaksiyalarining o`ziga xos xususiyatlari. Markovnikov qoidasi. Konjugatsiyalangan tizimlarga elektrofil qo'shilish xususiyatlari.
Elektrofil almashtirish reaksiyalari (Se): aromatik tizim ishtirokidagi geterolitik reaksiyalar. Arenalarda elektrofil o'rin almashish reaksiyalarining mexanizmi. Sigma komplekslari. Arenlarning alkillanish, atsillanish, nitrlash, sulfonlanish, galogenlash reaksiyalari. Orientatsiya qoidasi.
1 va 2 turdagi o'rinbosarlar. Geterosikllarda elektrofil o'rinbosar reaksiyalarining xususiyatlari. Geteroatomlarning yo'naltiruvchi ta'siri.
Sp3-gibridlangan uglerod atomida nukleofil o'rnini bosish (Sn) reaktsiyalari: uglerod-geteroatom sigma aloqasining qutblanishi natijasida yuzaga keladigan geterolitik reaktsiyalar (galogen hosilalari, spirtlar). Nukleofil almashinish reaksiyalarida birikmalarning reaktivligiga elektron va fazoviy omillarning ta'siri.
Galogen hosilalarining gidroliz reaktsiyasi. Spirtlar, fenollar, tiollar, sulfidlar, ammiak va aminlarning alkillanish reaksiyalari. Gidroksil guruhining nukleofil o'rnini bosishida kislota katalizining roli.
Birlamchi aminokislotali birikmalarning dezaminlanishi. Alkillanish reaksiyalarining biologik roli.
Eliminatsiya reaktsiyalari (dehidrogalogenatsiya, suvsizlanish).
sp3-gibridlangan uglerod atomida nukleofil almashtirish bilan birga olib boriladigan eliminatsiya reaktsiyalarining sababi sifatida CH kislotasining ortishi.
Nukleofil qo'shilish reaktsiyalari (An): pi uglerod-kislorod aloqasi (aldegidlar, ketonlar) ishtirokidagi geterolitik reaktsiyalar. Karbonil birikmalarining sinflari. Vakillar. Aldegidlar, ketonlar, karboksilik kislotalar tayyorlash. Karbonil guruhining tuzilishi va reaktivligi. Elektron va fazoviy omillarning ta'siri. Reaktsiyalar mexanizmi: karbonil reaktivligini oshirishda protonatsiyaning roli. Aldegidlar va ketonlarning biologik muhim reaksiyalari: gidrogenlanish, aldegidlarning oksidlanish-qaytarilishi (dismutatsiya reaksiyasi), aldegidlarning oksidlanishi, sianogidrinlarning hosil bo‘lishi, hidratlanish, yarimatsetallar, iminlarning hosil bo‘lishi. Aldol qo'shilishi reaktsiyalari. Biologik ahamiyati.
sp2-gibridlangan uglerod atomida nukleofil almashtirish reaktsiyalari (karboksilik kislotalar va ularning funktsional hosilalari).
sp2 gibridlangan uglerod atomida nukleofil almashinish reaksiyalari (Sn) mexanizmi. Asillanish reaksiyalari - angidridlar, efirlar, tioesterlar, amidlar hosil bo'lishi va ularning teskari gidroliz reaktsiyalari. Asillanish reaksiyalarining biologik roli. O-H guruhiga ko'ra karboksilik kislotalarning kislotali xossalari.
Organik birikmalarning oksidlanish va qaytarilish reaksiyalari.
Oksidlanish-qaytarilish reaksiyalari, elektron mexanizmi.
Organik birikmalardagi uglerod atomlarining oksidlanish darajalari. Birlamchi, ikkilamchi va uchinchi darajali uglerod atomlarining oksidlanishi. Har xil sinfdagi organik birikmalarning oksidlanish qobiliyati. Hujayrada kisloroddan foydalanish usullari.
Energetik oksidlanish. Oksidaza reaktsiyalari. Organik moddalarning oksidlanishi kimyotroflar uchun asosiy energiya manbai hisoblanadi. Plastik oksidlanish.
4 Organik birikmalarning biologik muhim sinflari Ko`p atomli spirtlar: etilenglikol, glitserin, inositol. Ta'lim gidroksi kislotalar: tasnifi, nomenklaturasi, sut, betagidroksibutirik, gammagidroksibutirik, olma, tartarik, limon, qaytaruvchi aminlanish, transaminatsiya va dekarboksillanish vakillari.
Aminokislotalar: tasnifi, beta va gamma-izomerlarning vakillari: aminopropan, gamma-aminobutirik, epsilonaminokaproik. Reaktsiya Salitsil kislotasi va uning hosilalari (atsetilsalitsil kislotasi, isitmani tushiruvchi, yallig'lanishga qarshi va revmatik vosita, enteroseptol va 5-NOK. Opiy alkaloidlari, antispazmodiklar (papaverin) va analjeziklar (morfin) asosi sifatida izokinolin yadrosi. dezinfektsiyalash vositalari.
ksantin hosilalari - kofein, teobromin va teofillin, indol hosilalari reserpin, strixnin, pilokarpin, kinolin hosilalari - xinin, izokinolin morfin va papaverin.
sefalosproinlar sefalosporan kislotasi hosilalari, tetratsiklinlar naftasen, streptomitsinlar amiloglikozidlar hosilalaridir. Yarim sintetik 5 Biopolimerlar va ularning tarkibiy qismlari. Lipidlar. Ta'rif. Tasniflash. Funksiyalar.
Siklo-oksoautomerizm. Mutarotatsiya. Monosaxaridlar deoksishakar (deoksiriboza) va aminokiskaridlar (glyukozamin, galaktozamin) hosilalari.
Oligosakkaridlar. Disaxaridlar: maltoza, laktoza, saxaroza. Tuzilishi. Oglikozid bog'lanish. Qayta tiklovchi xususiyatlar. Gidroliz. Biologik (aminokislotalarning parchalanish yo'li); radikal reaktsiyalar - gidroksillanish (aminokislotalarning kislorod hosilalari hosil bo'lishi). Peptid birikmalarining shakllanishi.
Peptidlar. Ta'rif. Peptidlar guruhining tuzilishi. Funksiyalar.
Biologik faol peptidlar: glutation, oksitotsin, vazopressin, glyukagon, neyropeptidlar, kinin peptidlari, immunoaktiv peptidlar (timozin), yallig'lanish peptidlari (difeksin). Sitokinlar haqida tushuncha. Antibiotik peptidlari (gramitsidin, aktinomitsin D, siklosporin A). Peptid toksinlari. Peptidlarning biologik ta'siri va ma'lum aminokislotalar qoldiqlari o'rtasidagi bog'liqlik.
Sincaplar. Ta'rif. Funksiyalar. Protein tuzilishi darajalari. Birlamchi tuzilish aminokislotalarning ketma-ketligidir. Tadqiqot usullari. Oqsillarning qisman va to'liq gidrolizlanishi. Oqsillarning birlamchi tuzilishini aniqlashning ahamiyati.
Oqsillarning funktsional faolligi va birlamchi tuzilish o'rtasidagi bog'liqlikni o'rganish usuli sifatida yo'naltirilgan o'ziga xos mutagenez. Proteinlarning birlamchi tuzilishining konjenital buzilishlari - nuqta mutatsiyalari. Ikkilamchi tuzilish va uning turlari (alfa spiral, beta struktura). Uchinchi darajali tuzilish.
Denaturatsiya. Faol markazlar tushunchasi. Oligomer oqsillarning to'rtlamchi tuzilishi. Kooperativ xususiyatlari. Oddiy va murakkab oqsillar: glikoproteinlar, lipoproteinlar, nukleoproteinlar, fosfoproteinlar, metalloproteinlar, xromoproteinlar.
Azotli asoslar, nukleozidlar, nukleotidlar va nuklein kislotalar.
Azotli asos, nukleozid, nukleotid va nuklein kislota tushunchalariga ta'rif. Purin (adenin va guanin) va pirimidin (urasil, timin, sitozin) azotli asoslar. Aromatik xususiyatlar. Biologik rolni bajarish uchun asos sifatida oksidlovchi degradatsiyaga qarshilik.
Laktim - laktam tautomeriyasi. Kichik azotli asoslar (gipoksantin, 3-N-metiluratsil va boshqalar). Azotli asoslarning hosilalari - antimetabolitlar (5-ftorouratsil, 6-merkaptopurin).
Nukleozidlar. Ta'rif. Azotli asos va pentoza o'rtasida glikozid bog'lanish hosil bo'lishi. Nukleozidlarning gidrolizi. Nukleozidlar antimetabolitlari (adenin arabinosid).
Nukleotidlar. Ta'rif. Tuzilishi. Pentozaning C5 gidroksilini fosfor kislotasi bilan esterifikatsiyalashda fosfoester bog'lanishining hosil bo'lishi. Nukleotidlarning gidrolizi. Makroerg nukleotidlari (nukleozid polifosfatlar - ADP, ATP va boshqalar). Nukleotid-kofermentlar (NAD+, FAD), B5 va B2 vitaminlarining tuzilishi, roli.
Nuklein kislotalar - RNK va DNK. Ta'rif. RNK va DNKning nukleotid tarkibi. Birlamchi tuzilma. Fosfodiester aloqasi. Nuklein kislotalarning gidrolizi. Triplet (kodon), gen (tsistron), genetik kod (genom) tushunchalarining ta'rifi. Inson genomi xalqaro loyihasi.
DNKning ikkilamchi tuzilishi. Ikkilamchi strukturaning hosil bo'lishida vodorod bog'larining roli. Azotli asoslarning to'ldiruvchi juftlari. DNKning uchinchi darajali tuzilishi. Kimyoviy moddalar ta'sirida nuklein kislotalar tuzilishining o'zgarishi. Mutagen moddalar haqida tushuncha.
Lipidlar. Ta'rifi, tasnifi. Sabunlanadigan va sabunlanmaydigan lipidlar.
Tabiiy yuqori yog'li kislotalar lipidlarning tarkibiy qismidir. Eng muhim vakillari: palmitik, stearik, oleyk, linoleik, linolenik, araxidonik, eikosapentaenoik, dokosoheksaenoik (F vitamini).
Neytral lipidlar. Asilgliserinlar - tabiiy yog'lar, yog'lar, mumlar.
Sun'iy iste'mol qilinadigan gidrofatlar. Atsilgliserinlarning biologik roli.
Fosfolipidlar. Fosfatid kislotalar. Fosfatidilkolinlar, fosfatidietanolaminlar va fosfatidilserinlar. Tuzilishi. Biologik membranalarning shakllanishida ishtirok etish. Hujayra membranalarida lipid peroksidatsiyasi.
Sfingolipidlar. Sfingozin va sfingomiyelinlar. Glikolipidlar (serebrozidlar, sulfatidlar va gangliozidlar).
Sabunlanmaydigan lipidlar. Terpenlar. Mono- va bisiklik terpenlar 6 Farmakologik xossalari Ayrim sinf monopoli va geterofunksional birikmalarning ayrim sinflarining farmakologik xossalari (galogen vodorod, spirtlar, oksi- va organik birikmalar. okso kislotalar, benzol hosilalari, geterosikllar, alkaloidlar.). Kimyoviy Ba'zi yallig'lanishga qarshi dorilar, analjeziklar, antiseptiklar va dorilar sinflarining kimyoviy tabiati. antibiotiklar.
6.3. Fanlar bo'limlari va dars turlari 1. Fanga kirish. Bioorganik birikmalarning tasnifi, nomenklaturasi va tadqiqi 2. Organik reaktivlik tuzilishining nazariy asoslari.
3. Organiklarning biologik muhim sinflari 5 Organik birikmalarning ayrim sinflarining farmakologik xususiyatlari. Ayrim toifadagi dorilarning kimyoviy tabiati L-ma'ruzalar; PZ - amaliy mashg'ulotlar; LR – laboratoriya ishi; C - seminarlar; SRS – talabalarning mustaqil ishi;
6.4 Fan bo`yicha ma`ruza mashg`ulotlarining tematik rejasi 1 1 Mavzuga kirish. Bioorganik kimyoning rivojlanish tarixi, 3 uchun ahamiyati 2 A.M.Butlerovning organik birikmalar tuzilishi nazariyasi. Izomeriya sifatida 4 2 Atomlarning o'zaro ta'siri: paydo bo'lish sabablari, turlari va uzatilish usullari 7 1.2 "Bioorganik birikmalarning tasnifi, nomenklaturasi va o'rganishning zamonaviy fizik-kimyoviy usullari" va "Organik birikmalar tuzilishining nazariy asoslari" bo'limlari bo'yicha sinov ishi. va ularning reaksiyasini belgilovchi omillar 15 5 Organik birikmalarning ayrim sinflarining farmakologik xossalari. Kimyoviy 19 4 14 Oliy karbonatlarning erimaydigan kalsiy tuzlarini aniqlash 1 1 Mavzuga kirish. Tasniflash va tavsiya etilgan adabiyotlar bilan ishlash.
bioorganik birikmalar nomenklaturasi. 3 uchun yozma topshiriqni bajarish 2 Molekulalardagi atomlarning o'zaro ta'siri Tavsiya etilgan adabiyotlar bilan ishlash.
4 2 Organik materiallarning kislotaliligi va asosligi Tavsiya etilgan adabiyotlar bilan ishlash.
5 2 Organik reaksiyalar mexanizmlari Tavsiya etilgan adabiyotlar bilan ishlash.
6 2 Organik moddalarning oksidlanishi va qaytarilishi Tavsiya etilgan adabiyotlar bilan ishlash.
7 1.2 Bo'limlar bo'yicha test ishi Tavsiya etilgan adabiyotlar bilan ishlash. * taklif etilayotgan mavzular boʻyicha zamonaviy fizikaviy-kimyoviy usullar, bioorganik birikmalar boʻyicha tadqiqotlar olib borish”, turli organik birikmalar va omillar boʻyicha maʼlumot qidirish, INTERNET va ingliz tilidagi maʼlumotlar bazalari bilan ishlash 8 3 Geterofunksional bioorganik Tavsiya etilgan adabiyotlar bilan ishlash.
9 3 Biologik muhim geterosikllar. Tavsiya etilgan adabiyotlar bilan ishlash.
10 3 Vitaminlar (laboratoriya ishi). Tavsiya etilgan adabiyotlar bilan ishlash.
12 4 Alfa aminokislotalar, peptidlar va oqsillar. Tavsiya etilgan adabiyotlar bilan ishlash.
13 4 Azotli asoslar, nukleozidlar, Tavsiya etilgan adabiyotlar bilan ishlash.
nukleotidlar va nuklein kislotalar. Yozma yozma topshiriqni bajarish 15 5 Ayrimlarning farmakologik xususiyatlari Tavsiya etilgan adabiyotlar bilan ishlash.
organik birikmalar sinflari. Yozish bo'yicha yozma topshiriqni bajarish Ba'zi dorivor moddalarning kimyoviy formulalarining ayrim sinflarining kimyoviy tabiati * - talaba tanlagan vazifalar.
organik birikmalar.
organik molekulalar.
organik molekulalar.
organik birikmalar.
organik birikmalar.
ulanishlar. Stereoizomerizm.
ba'zi dorilar toifalari.
Semestr davomida talaba amaliy mashg‘ulotlarda maksimal 65 ball to‘plashi mumkin.
Bitta amaliy darsda talaba maksimal 4,3 ball to‘plashi mumkin. Bu raqam darsga qatnashish (0,6 ball), sinfdan tashqari mustaqil ishlar uchun topshiriqni bajarish (1,0 ball), laboratoriya ishi (0,4 ball) va og‘zaki javob va test topshirig‘i (1,3 balldan) uchun berilgan ballardan iborat. 2,3 ball). Mashg'ulotlarga qatnashish, sinfdan tashqari mustaqil ishlar va laboratoriya ishlari uchun topshiriqlarni bajarish uchun ballar "ha" - "yo'q" asosida beriladi. Og'zaki javob va test topshirig'i uchun balllar ijobiy javoblar uchun 1,3 balldan 2,3 ballgacha farqlanadi: 0-1,29 ball “qoniqarsiz”, 1,3-1,59 ball – “qoniqarli”, 1,6-1,99 ball – “yaxshi”. ”, 2,0-2,3 – “a’lo”. Testda talaba maksimal 5,0 ball to‘plashi mumkin: darsga qatnashish 0,6 ball va og‘zaki javob berish 2,0-4,4 ball.
Imtihonga kirish uchun talaba kamida 45 ball to‘plashi kerak bo‘lsa, talabaning joriy faoliyati quyidagicha baholanadi: 65-75 ball – “a’lo”, 54-64 ball – “yaxshi”, 45-53 ball – “ qoniqarli”, 45 balldan kam – qoniqarsiz. Agar talaba 65 dan 75 ballgacha ("a'lo" natija) ball to'plagan bo'lsa, u testdan ozod qilinadi va avtomatik ravishda test uchun 25 ball to'plagan holda baholar kitobida "o'tish" bahosini oladi.
Testda talaba maksimal 25 ball to‘plashi mumkin: 0-15,9 ball “qoniqarsiz”, 16-17,5 ball – “qoniqarli”, 17,6-21,2 ball – “yaxshi”, 21,3-25 ball “ajoyib”.
Bonus ballarining taqsimlanishi (har bir semestrda jami 10 ballgacha) 1. Ma’ruza davomati – 0,4 ball (ma’ruzaga 100% qatnashish – semestrda 6,4 ball);
2. UIRSda 3 ballgacha ishtirok etish, shu jumladan:
taklif qilingan mavzu bo'yicha referat yozish - 0,3 ball;
Yakuniy o‘quv-nazariy konferensiya uchun ma’ruza va multimedia taqdimotini tayyorlash 3. Ilmiy-tadqiqot ishlarida ishtirok etish – 5 ballgacha, shu jumladan:
kafedradagi talabalar ilmiy to‘garagi yig‘ilishida qatnashish – 0,3 ball;
talabalar ilmiy to‘garagi yig‘ilishiga ma’ruza tayyorlash – 0,5 ball;
universitet talabalari ilmiy anjumanida ma’ruza qilish – 1 ball;
mintaqaviy, butun Rossiya va xalqaro talabalar ilmiy konferentsiyasida taqdimot - 3 ball;
talabalar ilmiy konferensiyalari to‘plamlarida nashr etish – 2 ball;
ekspertizadan o‘tgan ilmiy jurnalda nashr etish – 5 ball;
4. Kafedrada o‘quv-tarbiyaviy ishlarda qatnashish 3 ballgacha, shu jumladan:
sinfdan tashqari soatlarda kafedra tomonidan o‘tkaziladigan o‘quv-tarbiyaviy tadbirlarni tashkil etishda ishtirok etish - bir tadbir uchun 2 ball;
darsdan tashqari vaqtlarda kafedra tomonidan o‘tkaziladigan o‘quv mashg‘ulotlariga qatnashish – bitta tadbir uchun 1 ball;
Jarima ballarini taqsimlash (har bir semestrda jami 10 ballgacha) 1. Uzrsiz sababga ko‘ra ma’ruza darslariga qatnashmaslik – 0,66-0,67 ball (ma’ruzaga 0% qatnashish – 10 ball, agar talaba uzrli sababga ko‘ra darsni o‘tkazib yuborsa, u joriy reytingingizni yaxshilash uchun darsni ishlab chiqish huquqiga ega.
Agar uzrsiz bo'lsa, talaba darsni yakunlab, 0,8 pasaytirish koeffitsienti bilan baho olishi kerak.
Agar talaba darslarda jismoniy ishtirok etishdan ozod qilingan bo'lsa (akademiya buyrug'i bilan), agar u sinfdan tashqari mustaqil ish uchun topshiriqni bajarsa, unga maksimal ball beriladi.
6. Fanning o’quv, uslubiy va axborot ta’minoti 1. N.A.Tyukavkina, Yu.I.Baukov, S.E.Zurabyan. Bioorganik kimyo. M.: DROFA, 2009 yil.
2. Tyukavkina N.A., Baukov Yu.I. Bioorganik kimyo. M.: DROFA, 2005 yil.
1. Ovchinikov Yu.A. Bioorganik kimyo. M.: Ta'lim, 1987 yil.
2. Riles A., Smith K., Ward R. Organik kimyo asoslari. M.: Mir, 1983 yil.
3. Shcherbak I.G. Biologik kimyo. Tibbiyot maktablari uchun darslik. S.-P. Sankt-Peterburg davlat tibbiyot universiteti nashriyoti, 2005 yil.
4. Berezov T.T., Korovkin B.F. Biologik kimyo. M.: Tibbiyot, 2004 yil.
5. Berezov T.T., Korovkin B.F. Biologik kimyo. M.: Tibbiyot, Postupaev V.V., Ryabtseva E.G. Hujayra membranalarining biokimyoviy tashkil etilishi (tibbiyot oliy o'quv yurtlari farmatsevtika fakulteti talabalari uchun darslik). Xabarovsk, Uzoq Sharq davlat tibbiyot universiteti. 2001 yil
7. Soros ta'lim jurnali, 1996-2001.
8. Bioorganik kimyo fanidan laboratoriya mashg‘ulotlari uchun qo‘llanma. N.A.Tyukavkina tomonidan tahrirlangan, M.:
Tibbiyot, 7.3 Kafedra tomonidan tayyorlangan o‘quv-uslubiy materiallar 1. Talabalar uchun bioorganik kimyodan amaliy mashg‘ulotlarning uslubiy ishlanmasi.
2. Talabalarning sinfdan tashqari mustaqil ishlari uchun uslubiy ishlanmalar.
3. Borodin E.A., Borodina G.P. Biokimyoviy diagnostika (qon va siydikning biokimyoviy ko'rsatkichlarining fiziologik roli va diagnostik ahamiyati). Darslik 4-nashr. Blagoveshchensk, 2010 yil.
4. Borodina G.P., Borodin E.A. Biokimyoviy diagnostika (qon va siydikning biokimyoviy ko'rsatkichlarining fiziologik roli va diagnostik ahamiyati). Elektron darslik. Blagoveshchensk, 2007 yil.
5. Talabalarning bioorganik kimyo bo'yicha bilimlarini kompyuterda tekshirish uchun topshiriqlar (Tuzuvchilar Borodin E.A., Doroshenko G.K., Egorshina E.V.) Blagoveshchensk, 2003 yil.
6. Tibbiyot oliy o‘quv yurtlari tibbiyot fakulteti talabalari uchun bioorganik kimyodan imtihon uchun bioorganik kimyo fanidan test topshiriqlari. Asboblar to'plami. (Tuzuvchilar Borodin E.A., Doroshenko G.K.). Blagoveshchensk, 2002 yil.
7. Tibbiyot fakulteti talabalari uchun bioorganik kimyo fanidan amaliy mashg‘ulotlar uchun bioorganik kimyo fanidan test topshiriqlari. Asboblar to'plami. (Tuzuvchilar Borodin E.A., Doroshenko G.K.). Blagoveshchensk, 2002 yil.
8. Vitaminlar. Asboblar to'plami. (Tuzuvchi: Egorshina E.V.). Blagoveshchensk, 2001 yil.
8.5 Intizomni jihozlar va o'quv materiallari bilan ta'minlash 1 Kimyoviy shisha idishlar:
Shisha idishlar:
1.1 kimyoviy probirkalar 5000 Kimyoviy tajriba va amaliy mashgʻulotlarda tahlillar, UIRS, 1.2 sentrifuga naychalari 2000 Kimyoviy tajribalar va amaliy mashgʻulotlarda tahlillar, UIRS, 1.3 shisha tayoqchalar 100 Amaliy mashgʻulotlarda kimyoviy tajriba va tahlillar, UIRS, 1.4. turli hajmdagi kolbalar (200 ta Kimyoviy tajriba va amaliy mashg'ulotlarda tahlillar uchun, UIRS, 1,5 katta hajmli kolbalar - 0,5-2,0 30 Kimyoviy tajribalar va amaliy mashg'ulotlarda tahlillar, UIRS, 1,6 kimyoviy stakan turli xil 120 Kimyoviy tajriba va amaliy mashg'ulotlarda tahlillar, UIRS, 1,7 yirik kimyoviy stakan 50 Amaliy mashg'ulotlarda kimyoviy tajriba va tahlillar, UIRS, ishchilarni tayyorlash 1,8 turli o'lchamdagi kolbalar 2000 Amaliy mashg'ulotlarda kimyoviy tajriba va tahlillar, UIRS, 1,9 filtr voronkalari 200 Kimyoviy tajribalar va amaliy mashg'ulotlarda tahlillar, UIRS. 1.10 Shisha idishlar Amaliy mashg'ulotlarda kimyoviy tajribalar va tahlillar, CIRS, xromatografiya va boshqalar).
1.11 spirtli lampalar 30 Kimyoviy tajribalar va amaliy mashg'ulotlarda tahlillar, UIRS, Chinni idishlar 1,12 stakan turli hajmdagi (0,2- 30 Amaliy mashg'ulotlar uchun reagentlar tayyorlash 1,13 ohak va pestle Amaliy mashg'ulotlar uchun reagentlar tayyorlash, kimyoviy tajribalar va bug'lanish uchun 1,15 stakan 20 Kimyoviy tajribalar va amaliy mashg'ulotlar uchun tahlillar, UIRS, O'lchash idishlari:
1.16 turli xil hajmli oʻlchov kolbalari 100 Amaliy mashgʻulotlar uchun reagentlar tayyorlash, Kimyoviy tajribalar 1.17 Har xil 40 gradusli ballonlar Amaliy mashgʻulotlar uchun reagentlar tayyorlash, Kimyoviy tajribalar 1.18 turli hajmdagi stakanlar 30 Amaliy mashgʻulotlar uchun reaktivlar tayyorlash, Chem.10t. Amaliy mashg'ulotlar uchun kimyoviy tajribalar va tahlillar, UIRS, mikropipetlar) 1.20 mexanik avtomatik 15 Amaliy mashg'ulotlarda kimyoviy tajriba va tahlillar, UIRS, 1.21 mexanik avtomatik 2 Amaliy mashg'ulotlarda kimyoviy tajribalar va tahlillar, UIRS, o'zgaruvchan hajmli dispenserlar NIRS 1.22 elektron avtomat 1 Kimyoviy tajriba. va amaliy mashg'ulotlarda tahlillar, UIRS, 1.23 AC mikroshpritslari 5 Kimyoviy tajribalar va amaliy mashg'ulotlarda tahlillar, UIRS, 2 Texnik jihozlar:
2.1 Probirkalar uchun stendlar 100 Amaliy mashg'ulotlarda kimyoviy tajribalar va tahlillar, UIRS, 2,2 pipetkalar uchun stendlar 15 Amaliy mashg'ulotlarda kimyoviy tajribalar va tahlillar, UIRS, 2,3 metall stendlar 15 Amaliy mashg'ulotlarda kimyoviy tajribalar va tahlillar, UIRS, Isitish asboblari:
2,4 quritish shkaflari 3 Kimyoviy shisha idishlarni quritish, kimyoviy moddalarni saqlash uchun 2,5 havo termostatlari 2 2,6 suv termostatini aniqlashda inkubatsiya aralashmasini termostatizatsiya qilish 2 2,7 elektr pechkani aniqlashda inkubatsiya aralashmasini termostatizatsiya qilish 3 Amaliy mashg'ulotlar, kimyoviy tajribalar uchun reagentlarni tayyorlash va 2,8 Muzlatgichli muzlatgichlar 5 Kimyoviy reagentlar va biberologik materiallarni sararda saqlash. ”, “Biryusa”, amaliy mashqlar , UIRS, NIRS "Stinol"
2.9 Saqlash shkaflari 8 Kimyoviy reagentlarni saqlash 2.10 Metall seyf 1 Zaharli moddalarni saqlash reagentlar va etanol 3 Umumiy maqsadli uskunalar:
3.1 Analitik amortizator 2 Amaliy mashg'ulotlarda gravimetrik tahlil, UIRS, NIRS 3.6 Ultratsentrifuga 1 Amaliy mashg'ulotlarda sedimentatsiyani tahlil qilish usulini ko'rsatish (Germaniya) 3,8 Magnit aralashtirgichlar 2 Amaliy mashg'ulotlar uchun reagentlar tayyorlash 3.9 DE - elektr distillash uchun distillash 3.10 Termometrlar uchun reagentlar 10 Kimyoviy tahlillar paytida haroratni nazorat qilish 3.11 Gidrometrlar to'plami 1 Eritmalarning zichligini o'lchash 4 Maxsus jihozlar:
4.1 Elektroforez uchun apparatura 1. Sarum oqsillarini elektroforez qilish usulini koʻrsatish Amaliy yupqa xromatografiya qatlamida lipidlarni ajratish usuli. sinflar, NIRS o'lchash uskunalari:
Fotoelektrik kolorimetrlar:
4.8 Fotometr “SOLAR” 1 4.9 Spektrofotometr SF 16 da rangli eritmalarning yorug‘lik yutilishini o‘lchash 1 O‘lchov ko'rinadigan va ultrabinafsha hududlarda eritmalarning yorug'lik yutilishi 4.10 Klinik spektrofotometr 1 "Schimadzu - CL–770" spektrining ko'rinadigan va UV mintaqalarida eritmalarning yorug'lik yutilishini spektral aniqlash usullari yordamida o'lchash 4.11 Yuqori samarali HPLC usulini ko'rsatish 1 (amaliy mashqlar, UIRS, NIRS) suyuq xromatograf "Milichrome - 4".
4.12 Polarimetr 1 Enantiomerlarning optik faolligini ko'rsatish, 4.13 Refraktometr 1 Ko'rsatish Aniqlashning refraktometrik usuli 4,14 pH metr 3 Bufer eritmalarini tayyorlash, buferni ko'rsatish 5 Proyeksiyalash uskunasi:
5.1 Multimedia proyektori va 2 Multimediali taqdimotlar, foto va kodoproyektorlar namoyishi: ko'rsatish ma'ruza va amaliy mashg'ulotlar davomida slaydlar 5.3 "Yarim avtomatik podshipnik" 5.6 Namoyish uchun qurilma Morfologik o'quv binosiga ajratilgan. UIRS va NIRS kinoproyektori davomida ma'ruzalarda shaffof plyonkalar (ustki) va illyustrativ materiallarni namoyish qilish.
6 Kompyuter texnologiyasi:
6.1 Kafedralar tarmog‘i 1 Kafedra professor-o‘qituvchilari va talabalari uchun INTERNET ta’lim resurslaridan foydalanish (kimyo, biologiya va INTERNET tibbiyotiga oid xalqaro elektron ma’lumotlar bazasiga ega milliy va shaxsiy kompyuterlar) va 6.2 Shaxsiy kompyuterlar 8 Kafedra o‘qituvchilari tomonidan yaratilgan. Kafedraning bosma va elektron xodimlari bilan ishlash bo‘limi o‘quv-uslubiy ishlar davomida didaktik materiallar, 6.3 10 ta kompyuter sinfi 1 Amaliy mashg‘ulotlarda, test va imtihonlarda talabalar bilimini dasturlashtirilgan tekshirish (joriy, 7 ta O‘quv jadvallari:
1. Peptid aloqasi.
2. Polipeptid zanjiri tuzilishining muntazamligi.
3. Oqsil molekulasidagi bog’lanish turlari.
4. Disulfid bog‘i.
5. Oqsillarning turga xosligi.
6. Oqsillarning ikkilamchi tuzilishi.
7. Oqsillarning uchinchi darajali tuzilishi.
8. Mioglobin va gemoglobin.
9. Gemoglobin va uning hosilalari.
10. Qon plazmasi lipoproteinlari.
11. Giperlipidemiya turlari.
12. Qog'ozda oqsillarni elektroforezi.
13. Oqsil biosintezi sxemasi.
14. Kollagen va tropokollagen.
15. Miyozin va aktin.
16. Vitamin etishmasligi RR (pellagra).
17. B1 vitaminining etishmasligi.
18. Vitamin etishmasligi C.
19. Vitamin tanqisligi A.
20. D vitamini tanqisligi (raxit).
21. Prostaglandinlar to'yinmagan yog'li kislotalarning fiziologik faol hosilalaridir.
22. Katexalamin va indolaminlardan hosil bo'lgan neyroksinlar.
23. Dofaminning fermentativ bo'lmagan reaktsiyalari mahsuloti.
24. Neyropeptidlar.
25. Ko'p to'yinmagan yog'li kislotalar.
26. Liposomalarning hujayra membranasi bilan o'zaro ta'siri.
27. Erkin oksidlanish (to'qimalarning nafas olishidan farqlari).
28. Omega 6 va omega 3 oilalarining PUFAlari.
2 Dasturning turli bo'limlari uchun slaydlar to'plami 8.6 Interfaol ta'lim vositalari (Internet texnologiyalari), multimedia materiallari, Elektron kutubxonalar va darslik, foto va video materiallar 1 Interfaol ta'lim vositalari (Internet texnologiyalari) 2 Multimedia materiallari Stonik V.A. (TIBOH DSC SB RAS) «Tabiiy birikmalar asosdir 5 Borodin E.A. (AGMA) “Inson genomi. Genomika, proteomika va mualliflik taqdimoti 6 Pivovarova E.N (Rossiya Tibbiyot fanlari akademiyasining Sibir filiali Sitologiya va genetika instituti) “Gen ifodasini tartibga solishning roli Muallifning shaxs taqdimoti”.
3 Elektron kutubxonalar va darsliklar:
2 MEDLINE. Kimyo, biologiya va tibbiyot bo'yicha elektron ma'lumotlar bazalarining CD versiyasi.
3 Hayot fanlari. Kimyo va biologiya bo'yicha elektron ma'lumotlar bazalarining CD versiyasi.
4 Kembrij ilmiy tezislari. Kimyo va biologiya bo'yicha elektron ma'lumotlar bazalarining CD versiyasi.
5 PubMed - Milliy sog'liqni saqlash institutining elektron ma'lumotlar bazasi http://www.ncbi.nlm.nih.gov/pubmed/ Organik kimyo. Raqamli kutubxona. (Tuzuvchi N.F.Tyukavkina, A.I.Xvostova) - M., 2005 y.
Organik va umumiy kimyo. Dori. Talabalar uchun ma'ruzalar, kurs. (Elektron qo'llanma). M., 2005 yil
4 ta video:
3 MES TIBOKH DSC FEB RAS CD
5 Foto va video materiallar:Muallifning fotosuratlari va boshning video materiallari. Bo'lim prof. E.A.Borodin 1 ga yaqin Uppsala (Shvetsiya), Granada (Ispaniya), Yaponiya universitetlarining tibbiyot maktablari (Niigata, Osaka, Kanazava, Xirosaki), Rossiya Tibbiyot fanlari akademiyasining Biotibbiyot kimyo instituti, Fizik kimyo va kimyo instituti. Rossiya Sog'liqni saqlash vazirligi, TIBOKHE DSC. FEBR RAS.
8.1. 4-sonli “Kislotalik va asoslilik” darsi uchun joriy nazorat test topshiriqlariga misollar (standart javoblar bilan) organik molekulalar"
1. Bronsted-Loury kislotalarining xarakterli xususiyatlarini tanlang:
1. suvli eritmalarda vodorod ionlarining konsentratsiyasini oshirish 2. suvli eritmalarda gidroksid ionlari konsentratsiyasini oshirish 3. neytral molekulalar va ionlar - proton donorlari 4. neytral molekulalar va ionlar - proton qabul qiluvchilar 5. reaktsiyaga ta'sir qilmaydi. muhit 2. Organik molekulalarning kislotaligiga ta'sir qiluvchi omillarni ko'rsating:
1. geteroatomning elektromanfiyligi 2. geteroatomning qutblanishi 3. radikalning tabiati 4. dissotsilanish qobiliyati 5. suvda eruvchanligi 3. sanab oʻtilgan birikmalardan eng kuchli Bronsted kislotalarni tanlang:
1. alkanlar 2. aminlar 3. spirtlar 4. tiollar 5. karboksilik kislotalar 4. Asos xossalariga ega bo‘lgan organik birikmalarga xos xususiyatlarni ko‘rsating:
1. proton qabul qiluvchilar 2. proton donorlari 3. dissotsilanganda gidroksil ionlari beradi 4. dissotsiatsiyalanmaydi 5. asosiy xossalari reaktivlikni aniqlaydi 5. Berilgan birikmalardan eng kuchsiz asosni tanlang:
1. ammiak 2. metilamin 3. fenilamin 4. etilamin 5. propilamin 8.2 Joriy nazoratning vaziyatli vazifalariga misollar (bilan javob standartlari) 1. Birikmadagi ota-ona tuzilishini aniqlang:
Yechim. Organik birikmaning strukturaviy formulasida asosiy tuzilmani tanlash IUPAC o'rnini bosuvchi nomenklaturada bir qator izchil qo'llaniladigan qoidalar bilan tartibga solinadi (Darslik, 1.2.1-ga qarang).
Har bir keyingi qoida faqat avvalgisi aniq tanlov qilishga imkon bermasa qo'llaniladi. I birikma tarkibida alifatik va alitsiklik fragmentlar mavjud. Birinchi qoidaga ko'ra, ota-ona tuzilmasi sifatida katta xarakterli guruh bevosita bog'liq bo'lgan tuzilma tanlanadi. I birikmada (OH va NH) mavjud bo'lgan ikkita xarakterli guruhdan gidroksil guruhi eng qadimgi hisoblanadi. Shuning uchun boshlang'ich struktura siklogeksan bo'ladi, bu birikma nomida aks etadi - 4-aminometilsikloheksanol.
2. Bir qator biologik muhim birikmalar va preparatlarning asosini pirimidin va imidazol yadrolarini o'z ichiga olgan kondensatsiyalangan geterotsiklik purin tizimi tashkil etadi. Purinning oksidlanishga chidamliligi oshishi nima bilan izohlanadi?
Yechim. Aromatik birikmalar yuqori konjugatsiya energiyasiga va termodinamik barqarorlikka ega. Aromatik xususiyatlarning namoyon bo'lishidan biri bu "tashqi" bo'lsa-da, oksidlanishga qarshilik.
aromatik birikmalar yuqori darajada to'yinmaganlik darajasiga ega, bu odatda ularni oksidlanishga moyil qiladi. Muammo bayonotida berilgan savolga javob berish uchun purinning aromatik tizimlarga tegishli ekanligini aniqlash kerak.
Aromatiklik ta'rifiga ko'ra, konjugatsiyalangan yopiq tizimning paydo bo'lishi uchun zarur (lekin etarli emas) shart - bu molekulada bitta elektron bulutli tekis tsiklik skeletning mavjudligi. Purin molekulasida barcha uglerod va azot atomlari sp2 gibridlanish holatidadir va shuning uchun barcha aloqalar bir tekislikda yotadi. Shu sababli, tsiklga kiritilgan barcha atomlarning orbitallari skelet tekisligiga perpendikulyar va bir-biriga parallel joylashgan bo'lib, bu ularning barcha atomlarini qoplaydigan yagona yopiq delokalizatsiyalangan ti-elektron tizimining hosil bo'lishi bilan o'zaro qoplanishi uchun sharoit yaratadi. sikl (dumaloq konjugatsiya).
Xushbo'ylik 4/7 + 2 formulasiga to'g'ri kelishi kerak bo'lgan -elektronlarning soni bilan ham aniqlanadi, bu erda n - O, 1, 2, 3 va hokazo natural sonlar qatori (Gyukkel qoidasi). Har bir uglerod atomi va 1, 3 va 7 pozitsiyalardagi piridin azot atomlari konjugatsiyalangan tizimga bitta p-elektron hissa qo'shadi va 9-pozitsiyadagi pirrol azot atomi yolg'iz elektron juftligini qo'shadi. Konjugatsiyalangan purin tizimi 10 ta elektronni o'z ichiga oladi, bu Gyukel qoidasiga n = 2 da mos keladi.
Shunday qilib, purin molekulasi aromatik xususiyatga ega va uning oksidlanishga chidamliligi shu bilan bog'liq.
Purin siklida geteroatomlarning mavjudligi elektron zichligi notekis taqsimlanishiga olib keladi. Piridin azot atomlari elektronni tortib oluvchi xususiyatga ega va uglerod atomlarida elektron zichligini kamaytiradi. Shu munosabat bilan, odatda oksidlovchi birikma tomonidan elektronlarni yo'qotish deb hisoblangan purinning oksidlanishi benzolga nisbatan yanada qiyinroq bo'ladi.
8.3 Sinov uchun test topshiriqlari (javoblar standartlari bilan to'liq bitta variant) 1.Organogen elementlarni nomlang:
7.Si 8.Fe 9.Cu 2.Pi bogʻiga ega boʻlgan funksional guruhlarni koʻrsating:
1.Karboksil 2.aminoguruhi 3.gidroksil 4.oksoguruhi 5.karbonil 3.Yuqori funksional guruhni koʻrsating:
1.-C=O 2.-SO3H 3.-CII 4.-COOH 5.-OH 4.Glyukozaning anaerob parchalanishi natijasida toʻqimalarda hosil boʻlgan sut kislotasi CH3-CHOH-COOH qaysi sinf organik birikmalarga kiradi. , tegishli?
1. Karbon kislotalar 2. Gidroksi kislotalar 3. Aminokislotalar 4. Keto kislotalar 5. Hujayraning asosiy energiya yoqilg'isi bo'lgan va quyidagi tuzilishga ega bo'lgan moddani almashtirish nomenklaturasi bo'yicha nomlang:
CH2-CH -CH -CH -CH -C=O
I I III I
OH OH OH OH OH H
1. 2,3,4,5,6-pentagidroksigeksanal 2,6-oksoeksanepnentanol 1,2,3,4, 3. Glyukoza 4. Geksoza 5,1,2,3,4,5-pentagidroksigeksanal- 6. Konjugatsiyalanganlarning xarakterli xususiyatlarini ko‘rsating. tizimlari:1. Sigma va pi bog'larning elektron zichligini tenglashtirish 2. Barqarorlik va past reaktivlik 3. Beqarorlik va yuqori reaktivlik 4. O'zgaruvchan sigma va pi bog'larni o'z ichiga oladi 5. Pi bog'lari -CH2 guruhlari bilan ajratiladi 7. Qaysi birikmalar uchun Pi- Pi konjugasiyasi:
1. karotinlar va A vitamini 2. pirol 3. piridin 4. porfirinlar 5. benzpiren 8. Orto- va para-pozitsiyalarga yoʻnaltirilgan birinchi turdagi oʻrinbosarlarni tanlang:
1.alkil 2.- OH 3.- NH 4.- COOH 5.- SO3H 9. Alifatik spirtlarda -OH guruhi qanday taʼsir qiladi?
1. Musbat induktiv 2. Manfiy induktiv 3. Musbat mezomerik 4. Salbiy mezomerik 5. Taʼsir turi va belgisi -OH guruhining holatiga bogʻliq 10. Salbiy mezomer taʼsirga ega radikallarni tanlang 1. Galogenlar 2. Alkil radikallari 3. Amino guruhi 4. Gidroksiguruhi 5. Karboksi guruhi 11. Bronsted-Louri kislotalarining xarakterli belgilarini tanlang:
1. suvli eritmalarda vodorod ionlarining konsentratsiyasini oshirish 2. suvli eritmalarda gidroksid ionlari konsentratsiyasini oshirish 3. neytral molekulalar va ionlar - proton donorlari 4. neytral molekulalar va ionlar - proton qabul qiluvchilar 5. reaktsiyaga ta'sir qilmaydi. muhit 12. Organik molekulalarning kislotaligiga ta'sir qiluvchi omillarni ko'rsating:
1. geteroatomning elektromanfiyligi 2. geteroatomning qutblanishi 3. radikalning tabiati 4. dissotsilanish qobiliyati 5. suvda eruvchanligi 13. sanab oʻtilgan birikmalardan eng kuchli Bronsted kislotalarni tanlang:
1. alkanlar 2. aminlar 3. spirtlar 4. tiollar 5. karboksilik kislotalar 14. Asos xossalariga ega bo‘lgan organik birikmalarga xos xususiyatlarni ko‘rsating:
1. proton qabul qiluvchilar 2. proton donorlari 3. dissotsilanganda gidroksil ionlari beradi 4. dissotsiatsiyalanmaydi 5. asosiy xossalari reaktivlikni aniqlaydi 15. Berilgan birikmalardan eng kuchsiz asosni tanlang:
1. ammiak 2. metilamin 3. fenilamin 4. etilamin 5. propilamin 16. Organik birikmalarning reaksiyalari qanday xususiyatlar bilan tasniflanadi?
1. Kimyoviy bog‘lanishning uzilish mexanizmi 2. Reaksiyaning yakuniy natijasi 3. Butun jarayon tezligini belgilovchi bosqichda ishtirok etuvchi molekulalar soni 4. Bog‘ga hujum qiluvchi reaktivning tabiati 17. Aktivni tanlang. kislorod shakllari:
1. singlet kislorod 2. peroksid diradikal -O-O-Superoksid ioni 4. gidroksil radikal 5. uchlik molekulyar kislorod 18. Elektrofil reaktivlarning xarakterli belgilarini tanlang:
1.qisman yoki toʻliq musbat zaryad olib yuruvchi zarralar 2.kovalent bogʻlanishning gomolitik boʻlinishidan hosil boʻladi 3.juftlanmagan elektronni tashuvchi zarralar 4.qisman yoki toʻliq manfiy zaryad olib yuruvchi zarralar 5.geterolitik boʻlinish natijasida hosil boʻladi. kovalent bog'lanish 19. Xarakterli reaksiyalari elektrofil almashtirish bo'lgan birikmalarni tanlang:
1. alkenlar 2. arenlar 3. alkadienlar 4. aromatik geterotsikllar 5. alkanlar 20. Erkin radikal oksidlanish reaksiyalarining biologik rolini ko‘rsating:
1. Hujayralarning fagotsitar faolligi 2. Hujayra membranalarini yoʻq qilishning universal mexanizmi 3. Hujayra tuzilmalarining oʻz-oʻzini yangilashi 4. Koʻpgina patologik jarayonlarning rivojlanishida hal qiluvchi rol oʻynaydi 21. Organik birikmalarning qaysi sinflari nukleofil almashinish reaksiyalari bilan xarakterlanishini tanlang. :
1. spirtlar 2. aminlar 3. uglevodorodlarning galogen hosilalari 4. tiollar 5. aldegidlar 22. Nukleofil almashinish reaksiyalarida substratlarning reaktivligi qanday tartibda kamayadi?
1. uglevodorodlarning galogen hosilalari, amin spirtlari 2. amin spirtlari, uglevodorodlarning galogen hosilalari 3. amin spirtlari, uglevodorodlarning galogen hosilalari 4. uglevodorodlarning galogen hosilalari, amin spirtlari 23. sanab o‘tilgan birikmalardan ko‘p atomli spirtlarni tanlang:
1. etanol 2. etilen glikol 3. glitserin 4. ksilitol 5. sorbitol 24. Bu reaksiyaga nima xosligini tanlang:
CH3-CH2OH --- CH2=CH2 + H2O 1. eliminatsiya reaksiyasi 2. molekula ichidagi suvsizlanish reaksiyasi 3. qizdirilganda mineral kislotalar ishtirokida sodir bo‘ladi 4. normal sharoitda sodir bo‘ladi 5. molekulalararo degidratatsiya reaksiyasi 25. Organik moddada qanday xossalar paydo bo‘ladi. xlorli moddalar molekulasiga kiritiladi:
1. narkotik xossalari 2. lakrimator (yirtuvchi) 3. antiseptik xossalari 26. Okso birikmalardagi SP2-gibridlangan uglerod atomiga xos reaksiyalarni tanlang:
1. nukleofil qo'shilish 2. nukleofil almashtirish 3. elektrofil qo'shilish 4. gomolitik reaksiyalar 5. geterolitik reaksiyalar 27. Karbonil birikmalarining nukleofil hujumi qulayligi qanday tartibda kamayadi?
1. aldegidlar ketonlar angidridlar efirlar amidlar karboksilik kislotalar tuzlari 2. ketonlar aldegidlar angidridlar efirlar amidlar karboksilik kislotalar tuzlari 3. angidridlar aldegidlar ketonlar efirlar amidlar karboksilik kislotalarning tuzlari 28. Bu reaksiyaga xos xususiyatni aniqlang:
1.aldegidlarga sifat reaksiyasi 2.aldegid qaytaruvchi, kumush oksid (I) oksidlovchi 3.aldegid oksidlovchi, kumush oksid (I) qaytaruvchi 4.qaytarilish-qaytarilish reaksiyasi 5.ishqoriy moddada uchraydi. muhit 6.ketonlarning xarakteristikasi 29 .Quyidagi karbonil birikmalardan qaysi biri dekarboksillanishga uchrab biogen aminlarni hosil qiladi?
1. karboksilik kislotalar 2. aminokislotalar 3. okso kislotalar 4. gidroksi kislotalar 5. benzo kislotasi 30. Karboksilik kislotalarning gomologik qatorida kislota xossalari qanday o‘zgaradi?
1. o'sish 2. kamayishi 3. o'zgarmas 31. Taklif etilayotgan birikmalarning qaysi sinflari geterofunksional hisoblanadi?
1. gidroksi kislotalar 2. okso kislotalar 3. aminokislotalar 4. aminokislotalar 5. dikarbon kislotalar 32. gidroksid kislotalarga quyidagilar kiradi:
1. limon 2. butirik 3. asetoasetik 4. piruvik 5. olma 33. Tanlangan dorilar – salitsil kislotasi hosilalari:
1. paratsetamol 2. fenatsetin 3. sulfanilamidlar 4. aspirin 5. PAS 34. Tanlangan dorilar – p-aminofenol hosilalari:
1. paratsetamol 2. fenatsetin 3. sulfanilamidlar 4. aspirin 5. PAS 35. Tanlangan preparatlar – sulfanil kislota hosilalari:
1. paratsetamol 2. fenatsetin 3. sulfanilamidlar 4. aspirin 5. PASK 36. A.M.Butlerov nazariyasining asosiy qoidalarini tanlang:
1. uglerod atomlari oddiy va ko‘p bog‘lar bilan bog‘langan 2. organik birikmalarda uglerod to‘rt valentli 3. funksional guruh moddaning xossalarini aniqlaydi 4. uglerod atomlari ochiq va yopiq sikllar hosil qiladi 5. organik birikmalarda uglerod qaytarilgan shaklda bo‘ladi. 37. Qaysi izomerlar fazoviy deb tasniflanadi?
1. zanjirlar 2. ko‘p bog‘lanishlar o‘rni 3. funksional guruhlar 4. strukturaviy 5. konfiguratsion 38. “Konformatsiya” tushunchasiga nima xosligini tanlang:
1. bir yoki bir nechta sigma bog‘lari atrofida aylanish imkoniyati 2. konformerlar izomerlar 3. bog‘lanishlar ketma-ketligining o‘zgarishi 4. o‘rinbosarlarning fazoviy joylashuvining o‘zgarishi 5. elektron strukturasining o‘zgarishi 39. O‘zaro o‘xshashlikni tanlang. enantiomerlar va diastereomerlar:
1. bir xil fizik-kimyoviy xossalarga ega 2. yorug‘likning qutblanish tekisligini aylantira oladi 3. yorug‘likning qutblanish tekisligini aylantira olmaydi 4. stereoizomerlar 5. xirallik markazi mavjudligi bilan xarakterlanadi 40. Konfiguratsion va konformatsion izomeriya o'rtasidagi o'xshashlikni tanlang:
1. Izomeriya atomlar va atomlar guruhlarining fazodagi har xil pozitsiyalari bilan bog'liq 2. Izomeriya atomlar yoki atomlar guruhining sigma bog'i atrofida aylanishiga bog'liq 3. Izomeriya molekulada xirallik markazining mavjudligi bilan bog'liq. 4. Izomeriya o'rinbosarlarning pi bog'lanish tekisligiga nisbatan turlicha joylashishi bilan bog'liq.
41.Biologik muhim geterosikllarni tashkil etuvchi geteroatomlarni ayting:
1.azot 2.fosfor 3.oltingugurt 4.uglerod 5.kislorod 42.Porfirinlar tarkibiga kiruvchi 5 a’zoli geterosiklni ko‘rsating:
1.pirolidin 2.imidazol 3.pirol 4.pirazol 5.furan 43.Qaysi geterosikl bir geteroatomli nikotin kislotasi tarkibiga kiradi:
1. purin 2. pirazol 3. pirrol 4. piridin 5. pirimidin 44. Purinning organizmdagi oksidlanishining yakuniy mahsulotini ayting:
1. gipoksantin 2. ksantin 3. siydik kislotasi 45. Ko‘ksin alkaloidlarini ko‘rsating:
1. strixnin 2. papaverin 4. morfin 5. rezerpin 6. xinin 6. Inson organizmiga qanday oksidlanish reaksiyalari xos?
1.degidrogenlanish 2.kislorod qoʻshilishi 3.elektronlarning 4.galogenlar qoʻshilishi 5.kaliy permanganat, azot va perxlorik kislotalar bilan oʻzaro taʼsiri 47.Organik birikmalardagi uglerod atomining oksidlanish darajasini nima aniqlaydi:
1. vodorodga nisbatan elektron manfiyroq bo'lgan elementlar atomlari bilan bog'lanish soni 2. kislorod atomlari bilan bog'lanish soni 3. vodorod atomlari bilan bog'lanish soni 48. Birlamchi uglerod atomining oksidlanishida qanday birikmalar hosil bo'ladi?
1. birlamchi spirt 2. ikkilamchi spirt 3. aldegid 4. keton 5. karboksilik kislota 49. Oksidaza reaksiyalariga nima xosligini aniqlang:
1. kislorod suvga qaytariladi 2. kislorod oksidlangan molekula tarkibiga kiradi 3. kislorod substratdan ajralib vodorod oksidlanishiga boradi 4. reaksiyalar energetik qiymatga ega 5. reaksiyalar plastik qiymatga ega 50. Qaysi? taklif qilingan substratlarning hujayrada oksidlanishi osonroq va nima uchun?
1. glyukoza 2. yog 'kislotasi 3. qisman oksidlangan uglerod atomlarini o'z ichiga oladi 4. to'liq vodorodlangan uglerod atomlarini o'z ichiga oladi 51. Tanlangan aldozalar:
1. glyukoza 2. riboza 3. fruktoza 4. galaktoza 5. dezoksiriboza 52. Tirik organizmdagi uglevodlarning zaxira shakllarini tanlang:
1. tola 2. kraxmal 3. glikogen 4. gialurat kislota 5. saxaroza 53. Tabiatda eng keng tarqalgan monosaxaridlarni tanlang:
1. triozalar 2. tetrozalar 3. pentozalar 4. geksozalar 5. geptozalar 54. Tanlangan aminokislotalar:
1. beta-riboza 2. glyukozamin 3. galaktozamin 4. atsetilgalaktozamin 5. dezoksiriboza 55. Monosaxaridlarning oksidlanish mahsulotlarini tanlang:
1. glyukoza-6-fosfat 2. glikonik (aldon) kislotalar 3. glikuron (uron) kislotalar 4. glikozidlar 5. efirlar 56. Disaxaridlarni tanlang:
1. maltoza 2. tola 3. glikogen 4. saxaroza 5. laktoza 57. Gomopolisaxaridlarni tanlang:
1. kraxmal 2. tsellyuloza 3. glikogen 4. dekstran 5. laktoza 58. Laktoza gidrolizlanishida qaysi monosaxaridlar hosil boʻlishini tanlang:
1.beta-D-galaktoza 2.alfa-D-glyukoza 3.alfa-D-fruktoza 4.alfa-D-galaktoza 5.alfa-D-dezoksiriboza 59. Tsellyulozaga nima xosligini tanlang:
1. chiziqli, oʻsimlik polisaxaridi 2. tuzilish birligi beta-D-glyukoza 3. normal ovqatlanish uchun zarur, ballast moddadir 4. odamda asosiy uglevod 5. oshqozon-ichak traktida parchalanmaydi 60. Uglevod hosilalarini tanlang. muraminni tashkil etuvchi:
1.N-asetilglyukosamin 2.N-atsetilmuramin kislota 3.glyukozamin 4.glyukuron kislotasi 5.ribuloza-5-fosfat 61.Quyidagilardan toʻgʻri gaplarni tanlang: Aminokislotalar...
1. molekulasida aminokislotalar, ham gidroksil guruhlari bo'lgan birikmalar 2. gidroksil va karboksil guruhlari bo'lgan birikmalar 3. radikalida vodorod aminokislotalar bilan almashinadigan karboksilik kislotalarning hosilalari 4. molekulasida okso va karboksil guruhlari bo'lgan birikmalar. 5. gidroksi va aldegid guruhlari bo'lgan birikmalar 62. Aminokislotalar qanday tasniflanadi?
1. radikalning kimyoviy tabiati boʻyicha 2. fizik-kimyoviy xossalari boʻyicha 3. funksional guruhlar soni boʻyicha 4. toʻyinmaganlik darajasi boʻyicha 5. qoʻshimcha funksional guruhlarning tabiati boʻyicha 63. aromatik aminokislotalarni tanlang:
1. glitsin 2. serin 3. glutamik 4. fenilalanin 5. metionin 64. Kislotali xossaga ega aminokislotalarni tanlang:
1. leysin 2. triptofan 3. glitsin 4. glutamik kislota 5. alanin 65. Asosiy aminokislotalarni tanlang:
1. serin 2. lizin 3. alanin 4. glutamin 5. triptofan 66. purinli azotli asoslarni tanlang:
1. timin 2. adenin 3. guanin 4. urasil 5. sitozin 67. pirimidin azotli asoslarni tanlang:
1.urasil 2.timin 3.sitozin 4.adenin 5.guanin 68.Nukleozid tarkibiy qismlarini tanlang:
1.purinli azotli asoslar 2.pirimidin azotli asoslar 3.riboza 4.dezoksiriboza 5.fosfor kislotasi 69.Nukleotidlarning tuzilish qismlarini ko‘rsating:
1. purinli azotli asoslar 2. pirimidin azotli asoslar 3. riboza 4. dezoksiriboza 5. fosfor kislotasi 70. DNKning o‘ziga xos xususiyatlarini ko‘rsating:
1. bitta polinukleotid zanjiridan hosil boʻlgan 2. ikkita polinukleotid zanjiridan hosil boʻlgan 3. tarkibida riboza 4. tarkibida dezoksiriboza 5. tarkibida urasil 6. timin 71. saponlanadigan lipidlarni tanlang:
1. neytral yog‘lar 2. triatsilgliserinlar 3. fosfolipidlar 4. sfingomielinlar 5. steroidlar 72. to‘yinmagan yog‘ kislotalarini tanlang:
1. palmitik 2. stearik 3. oleyk 4. linoleik 5. araxidonik 73. Neytral yog‘larning xarakterli tarkibini ko‘rsating:
1.meritsil spirti + palmitik kislota 2.glitserin + butir kislotasi 3.sfingozin + fosfor kislotasi 4.glitserin + yuqori karboksilik kislota + fosforik kislota 5.glitserin + yuqori karboksilik kislotalar 74. Fosfolipidlar inson organizmida qanday vazifani bajarishini tanlang:
1. tartibga soluvchi 2. himoya 3. strukturaviy 4. energetik 75. Glikolipidlarni tanlang:
1.fosfatidilxolin 2.serebrozidlar 3.sfingomielinlar 4.sulfatidlar 5.gangliozidlar
TEST TOPSHIRIQLARIGA JAVOBLAR
8.4 O'tish uchun zarur bo'lgan amaliy ko'nikma va topshiriqlar ro'yxati (to'liq) 1. Organik birikmalarni uglerod skeletining tuzilishiga ko'ra tasniflay olish va 2. Biologik muhim moddalarning tipik vakillarini nomlash va nomlash bo'yicha formulalar tuzish qobiliyati. Strukturaviy formula bo'yicha dorilar.3. Kimyoviy xatti-harakatni aniqlash uchun molekulalarda funktsional guruhlar, kislotali va asosli markazlar, konjugatsiyalangan va aromatik bo'laklarni ajratib olish qobiliyati 4. Organik kimyoviy o'zgarishlarning yo'nalishi va natijasini bashorat qilish qobiliyati 5. O'quv, o'quv va ta'lim bilan mustaqil ishlash ko'nikmalariga ega bo'lish. ilmiy va ma'lumotnoma adabiyoti; qidiruv o'tkazish va umumiy xulosalar chiqarish.
6. Kimyoviy shisha idishlar bilan ishlash ko'nikmalariga ega bo'lish.
7. Kimyoviy laboratoriyada xavfsiz ishlash ko'nikmalariga ega bo'lish va o'yuvchi, zaharli, juda uchuvchan organik birikmalar bilan ishlash, yondirgichlar, spirtli lampalar va elektr isitish moslamalari bilan ishlash.
1. Bioorganik kimyo fanining predmeti va vazifalari. Tibbiyot ta'limiga ta'siri.
2. Organik birikmalarning elementar tarkibi, ularning biologik jarayonlarga mos kelishi sababi sifatida.
3. Organik birikmalarning tasnifi. Sinflar, umumiy formulalar, funktsional guruhlar, individual vakillar.
4. Organik birikmalarning nomenklaturasi. Arzimas nomlar. IUPAC nomenklaturasini almashtiring.
5. Asosiy funksional guruhlar. Ota-ona tuzilishi. Deputatlar. Guruhlarning kattaligi, deputatlar. Funktsional guruhlar va o'rinbosarlarning nomlari prefiks va oxirlar sifatida.
6. Organik birikmalar tuzilishining nazariy asoslari. A.M. Butlerov nazariyasi.
Strukturaviy formulalar. Strukturaviy izomeriya. Zanjir va joylashuv izomerlari.
7. Organik birikmalarning fazoviy tuzilishi. Stereokimyoviy formulalar.
Molekulyar modellar. Stereokimyodagi eng muhim tushunchalar organik molekulalarning konfiguratsiyasi va konformatsiyasidir.
8. Ochiq zanjirlarning konformatsiyalari - tutilgan, inhibe qilingan, qiya. Turli konformatsiyalarning energiyasi va reaktivligi.
9. Siklogeksan misolida sikllarning konformatsiyasi (stul va vanna). Eksenel va ekvatorial aloqalar.
10. Organik birikmalar molekulalarida atomlarning o'zaro ta'siri. Uning sabablari, namoyon bo'lish turlari. Molekulalarning reaktivligiga ta'siri.
11.Juftlash. Konjugat sistemalar, konjugat birikmalar. Dienlarda Pi-pi konjugasiyasi. Konjugatsiya energiyasi. Birlashtirilgan tizimlarning barqarorligi (A vitamini).
12. Arenalarda juftlashtirish (pi-pi juftligi). Xushbo'ylik. Gyukkel qoidasi. Benzol, naftalin, fenantren. Benzol halqasining reaktivligi.
13. Geterosikllarda konjugatsiya (pirol va piridin misolida p-pi va pi-pi konjugasiyasi).
Geterosikllarning barqarorligi - tetrapirol birikmalari misolida biologik ahamiyati.
14.Bog'larning qutblanishi. Sabablari. Spirtlarda, fenollarda, karbonil birikmalarida, tiollarda qutblanish. Molekulalarning reaktivligiga ta'siri.\ 15.Elektron effektlar. Sigma aloqalarini o'z ichiga olgan molekulalarda induktiv ta'sir. Induktiv effekt belgisi.
16. 1,3 butadien misolida konjugatsiyalangan pi bog'langan ochiq zanjirlarda mezomer effekt.
17.Aromatik birikmalarda mezomer effekti.
18.Elektron beruvchi va elektron tortib oluvchi o'rinbosarlar.
19. 1 va 2-turdagi deputatlar. Benzol halqasida orientatsiya qoidasi.
20.Organik birikmalarning kislotaliligi va asosligi. Brendstet-Lowri kislotalari va asoslari.
Kislota-asos juftlari konjugat kislotalar va asoslardir. Ka va pKa - organik birikmalarning kislotaliligining miqdoriy ko'rsatkichlari. Organik molekulalarning funksional faolligi uchun kislotalikning ahamiyati.
21.Har xil sinfdagi organik birikmalarning kislotaligi. Organik birikmalarning kislotaliligini belgilovchi omillarga vodorod bilan bog'langan metall bo'lmagan atomning elektr manfiyligi, metall bo'lmagan atomning qutblanishi, metall bo'lmagan atom bilan bog'langan radikalning tabiati kiradi.
22.Organik asoslar. Ominlar. Asosiylik sababi. Alifatik va aromatik aminlarning asosligiga radikallarning ta'siri.
23. Organik birikmalar reaksiyalarining mexanizmiga ko‘ra tasnifi. Gomolitik va geterolitik reaksiyalar haqida tushunchalar.
24. Alkanlarda radikal almashinish reaksiyalari. Tirik organizmlarda erkin radikal oksidlanish. Reaktiv kislorod turlari.
25. Alkenlarda elektrofil qo'shilish. Pi-komplekslarning, karbokationlarning hosil bo'lishi. Gidratsiya, gidrogenlanish reaksiyalari.
26.Aromatik halqadagi elektrofil almashtirish. Oraliq sigma komplekslarining shakllanishi. Benzolning bromlanish reaksiyasi.
27.Spirtlilarda nukleofil o'rin almashish. Suvsizlanish reaksiyalari, birlamchi va ikkilamchi spirtlarning oksidlanishi, efirlarning hosil bo`lishi.
28.Karbonil birikmalarining nukleofil qo'shilishi. Aldegidlarning biologik muhim reaktsiyalari: oksidlanish, spirtlar bilan o'zaro ta'sirlashganda hemiatsetallarning hosil bo'lishi.
29.Karboksilik kislotalarda nukleofil almashinish. Karboksilik kislotalarning biologik muhim reaksiyalari.
30. Organik birikmalarning oksidlanishi, biologik ahamiyati. Organik molekulalarda uglerodning oksidlanish darajasi. Turli sinfdagi organik birikmalarning oksidlanish qobiliyati.
31. Energetik oksidlanish. Oksidaza reaktsiyalari.
32. Energetik bo'lmagan oksidlanish. Oksigenaza reaktsiyalari.
33. Fagotsitar hujayralarning bakteritsid ta'sirida erkin radikal oksidlanishning ahamiyati.
34. Organik birikmalarning tiklanishi. Biologik ahamiyati.
35.Ko‘p funksiyali birikmalar. Ko'p atomli spirtlar - etilen glikol, glitserin, ksilitol, sorbitol, inositol. Biologik ahamiyati. Glitserinning biologik muhim reaktsiyalari oksidlanish va efirlarning hosil bo'lishidir.
36.Ikki asosli dikarbon kislotalar: oksalat, malonik, suksinik, glutarik.
Süksin kislotasining fumarik kislotaga aylanishi biologik dehidrogenatsiyaga misol bo'la oladi.
37. Ominlar. Tasnifi:
Radikalning tabiati bo'yicha (alifatik va aromatik); -radikallar soni bo'yicha (birlamchi, ikkilamchi, uchinchi, to'rtlamchi ammoniy asoslari); -aminokislotalar soni bo'yicha (mono- va diaminlar-). Diaminlar: putresin va kadaverin.
38. Geterofunksional birikmalar. Ta'rif. Misollar. Kimyoviy xususiyatlarning namoyon bo'lish xususiyatlari.
39. Amino spirtlari: etanolamin, xolin, atsetilxolin. Biologik ahamiyati.
40.Gidroksikislotalar. Ta'rif. Umumiy formula. Tasniflash. Nomenklatura. Izomerizm.
Monokarboksilik gidroksi kislotalarning vakillari: sut, beta-gidroksibutirik, gamma-ksibutirik;
dikarbonat: olma, sharob; trikarboksilik: limon; aromatik: salitsil.
41. Gidroksikislotalarning kimyoviy xossalari: karboksil bo‘yicha, gidroksil guruhi bo‘yicha, alfa, beta va gamma-izomerlarning suvsizlanish reaksiyalari, reaksiya mahsulotlarining farqi (laktidlar, to‘yinmagan kislotalar, laktonlar).
42.Stereoizomerizm. Enantiomerlar va diastereomerlar. Optik izomeriya sababi sifatida organik birikmalar molekulalarining xiralligi.
43. Bitta xirallik markaziga ega enantiomerlar (sut kislotasi). Enantiomerlarning mutlaq va nisbiy konfiguratsiyasi. Oksid kislotasi kaliti. D va L glitseraldegid. D va L izomerlari.
Poygadoshlar.
44. Bir nechta xirallik markazlariga ega enantiomerlar. Tartarik va mezotartar kislotalar.
45.Stereoizomeriya va stereoizomerlarning biologik faolligi.
46.Fumarik va malein kislotalar misolida sis-va trans-izomeriya.
47.Oksosidlar. Ta'rif. Biologik muhim vakillari: pirouzum kislotasi, atsetosirka kislotasi, oksalosirka kislotasi. Pirouzum kislotasi misolida ketoenol tautomeriyasi.
48. Aminokislotalar. Ta'rif. Umumiy formula. Aminoguruh pozitsiyasining izomerlari (alfa, beta, gamma). Alfa aminokislotalarning biologik ahamiyati. Beta-, gamma- va boshqa izomerlarning vakillari (beta-aminopropionik, gamma-aminobutirik, epsilonaminokaproik). Siklik laktonlarning hosil bo'lishi bilan gamma-izomerlarning suvsizlanish reaktsiyasi.
49. Dori vositalarining asosi sifatida geterofunksional benzol hosilalari. P-aminobenzoy kislotasining hosilalari - PABA (foliy kislotasi, anestezin). PABA antagonistlari sulfanilik kislota hosilalari (sulfanilamidlar - streptotsid).
50. Geterofunksional benzol hosilalari - dori vositalari. Raminofenol hosilalari (paratsetamol), salitsil kislotasi hosilalari (atsetilsalitsil kislotasi). Raminosalisil kislotasi - PAS.
51.Biologik muhim geterosikllar. Ta'rif. Tasniflash. Tuzilishi va xossalarining xususiyatlari: konjugatsiya, aromatiklik, barqarorlik, reaktivlik. Biologik ahamiyati.
52. Bir geteroatomli besh a'zoli geterosikllar va ularning hosilalari. Pirol (porfin, porfirinlar, gem), furan (dorilar), tiofen (biotin).
53. Ikki geteroatomli besh a'zoli geterosikllar va ularning hosilalari. Pirazol (5-okso hosilalari), imidazol (histidin), tiazol (vitamin B1-tiamin).
54. Bitta geteroatomli olti a'zoli geterosikllar va ularning hosilalari. Piridin (nikotin kislotasi - redoks reaktsiyalarida ishtirok etish, vitamin B6-piridoksal), xinolin (5-NOK), izokinolin (alkaloidlar).
55. Ikki geteroatomli olti a'zoli geterosikllar. Pirimidin (sitozin, urasil, timin).
56.Birlashtirilgan geterosikllar. Purin (adenin, guanin). Purin oksidlanish mahsulotlari hipoksantin, ksantin, siydik kislotasi).
57. Alkaloidlar. Ta'rifi va umumiy xususiyatlari. Nikotin va kofeinning tuzilishi.
58.Uglevodlar. Ta'rif. Tasniflash. Tirik organizmlardagi uglevodlarning vazifalari.
59.Monoshakarlar. Ta'rif. Tasniflash. Vakillar.
60.Pentozalar. Vakillari riboza va deoksiriboza. Struktura, ochiq va siklik formulalar. Biologik ahamiyati.
61.Geksozlar. Aldozlar va ketozlar. Vakillar.
62.Monosaxaridlarning ochiq formulalari. Stereokimyoviy konfiguratsiyani aniqlash. Monosaxaridlar konfiguratsiyasining biologik ahamiyati.
63. Monosaxaridlarning siklik shakllarining hosil bo'lishi. Glikozid gidroksil. Alfa va beta anomerlari. Xovort formulalari.
64. Monosaxaridlarning hosilalari. Fosfor efirlari, glikonik va glikuronik kislotalar, aminokislotalar va ularning atsetil hosilalari.
65. Maltoza. Tarkibi, tuzilishi, gidrolizlanishi va ahamiyati.
66. Laktoza. Sinonim. Tarkibi, tuzilishi, gidrolizlanishi va ahamiyati.
67.Saxaroza. Sinonimlar. Tarkibi, tuzilishi, gidrolizlanishi va ahamiyati.
68. Gomopolisaxaridlar. Vakillar. Kraxmal, tuzilishi, xossalari, gidroliz mahsulotlari, ahamiyati.
69.Glikogen. Tuzilishi, hayvon organizmidagi roli.
70. Elyaf. Tuzilishi, o'simliklardagi roli, odamlar uchun ahamiyati.
72. Geteropolisaxaridlar. Sinonimlar. Funksiyalar. Vakillar. Strukturaviy xususiyatlar: dimer birliklari, tarkibi. 1,3- va 1,4-glikozid bog'lar.
73. Gialuron kislotasi. Tarkibi, tuzilishi, xossalari, organizmdagi ahamiyati.
74.Xondroitin sulfat. Tarkibi, tuzilishi, organizmdagi ahamiyati.
75. Muramin. Tarkibi, ma'nosi.
76. Alfa aminokislotalar. Ta'rif. Umumiy formula. Nomenklatura. Tasniflash. Shaxsiy vakillar. Stereoizomerizm.
77. Alfa-aminokislotalarning kimyoviy xossalari. Amfoterlik, dekarboksillanish reaksiyalari, dezaminlanish, radikalda gidroksillanish, peptid bog` hosil bo`lishi.
78. Peptidlar. Individual peptidlar. Biologik rol.
79. Sincaplar. Proteinlarning funktsiyalari. Tuzilish darajalari.
80. Nuklein kislotalarning azotli asoslari - purinlar va pirimidinlar. O'zgartirilgan azotli asoslar - antimetabolitlar (ftorouratsil, merkaptopurin).
81. Nukleozidlar. Nukleozidli antibiotiklar. Nukleotidlar. Nuklein kislotalar va erkin nukleotidlar tarkibidagi mononukleotidlar kofermentlardir.
82. Nuklein kislotalar. DNK va RNK. Biologik ahamiyati. Mononukleotidlar o'rtasida fosfodiester bog'larning hosil bo'lishi. Nuklein kislotalarning tuzilish darajalari.
83. Lipidlar. Ta'rif. Biologik rol. Tasniflash.
84.Yuqori karboksilik kislotalar - to'yingan (palmitik, stearik) va to'yinmagan (oleik, linoleik, linolenik va araxidonik).
85. Neytral yog'lar - atsilgliserinlar. Tuzilishi, ma'nosi. Hayvon va o'simlik yog'lari.
Yog'larning gidrolizi - mahsulotlar, ma'nosi. O'simlik moylarini, sun'iy yog'larni gidrogenlash.
86. Glitserofosfolipidlar. Tuzilishi: fosfatid kislota va azotli asoslar.
Fosfatidilxolin.
87. Sfingolipidlar. Tuzilishi. Sfingozin. Sfingomiyelin.
88. Steroidlar. Xolesterin - tuzilishi, ma'nosi, hosilalari: o't kislotalari va steroid gormonlar.
89.Terpenlar va terpenoidlar. Tuzilishi va biologik ahamiyati. Vakillar.
90.Yog'da eriydigan vitaminlar. Umumiy xususiyatlar.
91. Anesteziya. Dietil efir. Xloroform. Ma'nosi.
92. Metabolik jarayonlarni rag'batlantiruvchi dorilar.
93. Sulfanilamidlar, tuzilishi, ahamiyati. Oq streptotsid.
94. Antibiotiklar.
95. Yallig'lanishga qarshi va isitmani tushiruvchi preparatlar.Paratsetamol. Tuzilishi. Ma'nosi.
96. Antioksidantlar. Xarakterli. Ma'nosi.
96. Tiollar. Antidotlar.
97. Antikoagulyantlar. Xarakterli. Ma'nosi.
98. Barbituratlar. Xarakterli.
99. Analjeziklar. Ma'nosi. Misollar. Asetilsalitsil kislotasi (aspirin).
100. Antiseptiklar. Ma'nosi. Misollar. Furatsilin. Xarakterli. Ma'nosi.
101. Virusga qarshi preparatlar.
102. Diuretiklar.
103. Parenteral oziqlantirish uchun vositalar.
104. PABC, PASK. Tuzilishi. Xarakterli. Ma'nosi.
105. Yodoform. Kseroform. Ma'nosi.
106. Poliglyukin. Xarakterli. Qiymat 107.Formalin. Xarakterli. Ma'nosi.
108. Ksilitol, sorbitol. Tuzilishi, ma'nosi.
109. Resorsinol. Tuzilishi, ma'nosi.
110. Atropin. Ma'nosi.
111. Kofein. Tuzilishi. Qiymat 113. Furatsilin. Furazolidon. Xarakterli. Qiymat.
114. GABA, GHB, suksin kislotasi.. Tuzilishi. Ma'nosi.
115. Nikotin kislotasi. Tuzilishi, ma'nosi
| yili Saxa Respublikasi (Yakutiya) Strategik tadqiqotlar markazi tomonidan tashkil etilgan xalqaro ishtirokida Saxa Respublikasida (Yakutiya) mehnat bozorini tartibga solish mexanizmlarini takomillashtirish mavzusida seminar bo'lib o'tdi. Seminarda xorijdagi yetakchi ilmiy muassasalar, Rossiya Federatsiyasi, Uzoq Sharq federal...” vakillari ishtirok etdilar. “Novosibirsk davlat suv transporti akademiyasi intizom kodi: F.02, F.03 Materialshunoslik. Strukturaviy materiallar texnologiyasi Mutaxassisliklar bo'yicha ish dasturi: 180400 Sanoat qurilmalari va texnologik komplekslarini elektr haydovchi va avtomatlashtirish va 240600 Kema elektr jihozlari va avtomatlashtirishdan foydalanish Novosibirsk 2001 Ish dasturi dotsent S.V. Gorelov oliy kasb-hunar ta'limi davlat ta'lim standarti asosida..." “I.M. Gubkina Ilmiy ishlar bo'yicha prorektor tomonidan tasdiqlangan prof. A.V. Muradov 2014-yil 31-mart kuni I.M. Gubkin 2014/2015 o'quv yilida. yil Moskva 2014 yil 06/15/01 Mashinasozlik yo'nalishi bo'yicha kirish test dasturi ilmiy mutaxassisliklar pasportlarida belgilangan talablar asosida ishlab chiqilgan (02/05/04,..." “5A-ilova: “Aqliy rivojlanish psixologiyasi” maxsus fanining ish dasturi PYATIGORSK DAVLAT LINGVISTIKA OLIY TA’LIM FEDERAL DAVLAT BUDJET TA’LIM MASSASASI Z.A.Universitetning ilmiy ishlar va potentsial rivojlanish bo‘yicha prorektori tomonidan tasdiqlangan. Zavrumov _2012 yil 19.00.07 Pedagogik psixologiya fan boʻlimi: 19.00.00 Psixologiya fanlari kafedrasi... mutaxassisligi boʻyicha aspirantura. “Kabardin-Balkar davlat oʻrta kasb-hunar taʼlimi taʼlim muassasasi Taʼlim va fan vazirligi Kabardino-Balkar avtomobil va avtomobil yoʻllari kolleji Tasdiqlangan: KBADK oʻrta kasb-hunar taʼlimi davlat taʼlim muassasasi direktori M.A. Abregov 2013 Kasb bo'yicha malakali ishchilar, xodimlar uchun o'quv dasturi 190631.01.01 Avtomexanik malakasi Avtomobil ta'mirlash ustasi. Avtomobil haydovchisi, yoqilg'i quyish shoxobchasi operatori tayyorlash shakli - kunduzgi Nalchik, 2013 MAZMUNI 1. XUSUSIYATLAR..." "Tibbiyot ilmiy markazi" qo'shma korxonasida (Novgorod) ishlab chiqilgan organlarni qon bilan ta'minlash mexanizmining an'anaviy nuqtai nazariga asoslangan yurak ishemik kasalligining matematik modelining mohiyati ochib berilgan. Statistik ma'lumotlarga ko'ra, hozirgi vaqtda yurak ishemik kasalligi (KY) kasallanish bo'yicha birinchi o'rinda turadi..." “Rossiya Federatsiyasi transport vazirligi FEDERAL TEmir yo'l transporti agentligi federal davlat byudjetli oliy kasbiy ta'lim muassasasi IRKUTSK DAVLAT TRANSPORTLAR UNIVERSITETI IRGUPS (IrIIT) EMF dekani tomonidan TASDIQLANGAN EMF.Py. 2011 ISHLAB CHIQARISH AMALIYASI ISH DASTURI C5. P Sanoat amaliyoti, 3-kurs. Mutaxassisligi 190300.65 Temir yo'l harakatlanuvchi tarkibi Mutaxassisligi PSG.2 Avtomobillar Bitiruvchi malakalari..." “RF TA’LIM VA FAN VAZIRLIGI Federal davlat byudjeti oliy kasbiy ta’lim muassasasi Tver davlat universiteti fizika-texnika fakulteti Umumiy fizika kafedrasi TASDIQLANGAN Fizika-texnika fakulteti dekani B.B. Pedko 2012 3-kurs kunduzgi bo'lim talabalari uchun ATOM YADARI VA INTERKENT zarrachalari FIZIKASI fanining ish dasturi 222000.62 - Innovatsiyalar, profil innovatsiyalarni boshqarish (tarmoqlar va yo'nalishlar bo'yicha..." “Rossiya Davlat OLIY TA’LIM VORONEJ DAVLAT UNIVERSITETI (GOU VPO VSU) TA’LIM FANI VAZIRLIGI TASDIQLANGAN Mehnat huquqi kafedrasi mudiri Perederin S.V. 21.01.2011 B 3.b.13 O'quv fanining ishchi dasturi Yer huquqi 1. Ta'lim yo'nalishi/mutaxassisligining shifr va nomi: 030900 Yurisprudensiya 2. Ta'lim/mutaxassislik profili: huquqshunoslik_ 3. Malaka (daraja) bitiruvchi: huquqshunoslik bakalavriati_ 4. Shakl .. shakl .. ”. "Ish dasturi Oliy kasbiy ta'lim bo'yicha Federal davlat ta'lim standarti asosida va 130400.65 konchilik, ixtisoslik 130400.65.10 konchilik ishlab chiqarishini elektrlashtirish va avtomatlashtirish bo'yicha mutaxassislarni tayyorlash bo'yicha Taxminiy asosiy ta'lim dasturining tavsiyalarini hisobga olgan holda tuzilgan. 1. Fanni o'zlashtirish maqsadlari "Elektr mashinalari" fanining asosiy maqsadi talabalarning zamonaviy elektromexanika bo'yicha nazariy asoslarini ishlab chiqish ... " “Mundarija I. Izoh 3 II. 2013-yilda strategik rivojlanish dasturini 6- amalga oshirish jarayonida erishilgan asosiy natijalar III. 2-ilovalar I. Tushuntirish xati Universitetni strategik rivojlantirish dasturining maqsad va vazifalari dasturning butun amal qilish muddati davomida oʻzgarishsiz qoladi va uni amalga oshirishning har bir yilida bosqichma-bosqich erishiladi, bu esa izohli dasturga ilovada belgilangan koʻrsatkichlarga erishishni taʼminlaydi. . 1-maqsad Ilg‘or ta’lim texnologiyalarini rivojlantirish Maqsad...” "Rossiya Federatsiyasi Ta'lim va fan vazirligi Rossiya Federatsiyasi Ta'lim bo'yicha Federal agentligi Vladivostok Davlat Iqtisodiyot va Xizmat Universiteti _ SIYOSIY FALSAFA 03020165 Siyosatshunoslik Vladivostok nashriyoti VGUES 2068 yo'nalishi bo'yicha kurs ixtisosligi bo'yicha o'quv dasturi. Siyosiy falsafa Rossiya Federatsiyasi Oliy kasbiy ta'limning Davlat ta'lim standarti talablariga muvofiq tuzilgan. Kursning predmeti siyosat murakkab ijtimoiy hodisa sifatida, uning qadriyatlari va maqsadlari, texnologiyalari va...” “MUTAXSISLIK BO‘YICHA NOMIZATLARNI IMTIHON O‘TISH DASTURI s. 2 ning 5 05.16.04 QUYIMCHILIK ISHLAB CHIQISHI Mutaxassislik bo'yicha nomzodlik imtihonining ushbu savollari Rossiya Federatsiyasi Ta'lim va fan vazirligining buyrug'i bilan tasdiqlangan 05.16.04 Quymachilik mutaxassisligi bo'yicha nomzodlik imtihon dasturiga muvofiq tuzilgan. 08.10.2007 yildagi 274-son. 1 SAVOLLAR RO'YXATI 1. Mashinasozlikda qo'llaniladigan quyma qotishmalarning tasnifi. Qotishmalarning asosiy parametrlari: erish nuqtasi,..." “Kollej xodimlari V.V.Malkovning MO SPO MKETI davlat avtonom ta'lim muassasasi mehnat direktori yig'ilishida ko'rib chiqildi va qabul qilindi, 2013 yildagi _-sonli bayonnoma Murmansk iqtisodiyot va axborot texnologiyalari kollejini 2013 yil uchun rivojlantirishning uzoq muddatli maqsadli dasturi. -2015 yil Murmansk 2013 yil 2 1. Kollejni rivojlantirish dasturi pasporti. Nomi Uzoq muddatli maqsadli dastur Murmansk iqtisodiyot va axborot texnologiyalari kollejini 2013 yil uchun ishlab chiqish dasturi (keyingi o'rinlarda Dastur deb yuritiladi) Rossiya Federatsiyasi qonunining asoslari dan...” "Rossiya Federatsiyasi Ta'lim va fan vazirligi Federal davlat byudjeti oliy kasbiy ta'lim muassasasi MOSKVA DAVLAT O'rmon universiteti o'rmon xo'jaligi fakulteti Sun'iy o'rmon xo'jaligi a s h i n a i m a n i z a t i o n i z a t i m a n i z a t i m a n i z a t i m a n i z a t i o n i n i n i l / agri BUG BUG ning O'rmon xo'jaligi fakulteti. ^AJTAEBJUX*DASTURI O'rmon xo'jaligi ekinlari bo'limi Sun'iy..." ASPIRANTURAGA KABUL IMTIHONI "Intizom". “FEDERAL FUQARO AVIATSIYA AGENTLIGI MOSKVA DAVLAT FUQARO AVIATSIYASI TEKNIK UNIVERSITETI MMR boʻyicha prorektor V.V.Krinitsin TASDIQLANGAN _2007-yil. FANNING ISHLAB CHIQISH O'QUV DASTURI Termodinamika va issiqlik almashinuvi, SD.04 (nomi, kod GOS bo'yicha) Mutaxassisligi 160901 Samolyot va dvigatellarning texnik ekspluatatsiyasi (kodi GOS bo'yicha) Fakultet - Mexanika bo'limi - Aviatsiya dvigatellari Kurs - 3 O'quv shakli - kunduzgi Semestr O'quv soatlarining umumiy miqdori...” “MC45 b FOYDALANUVCHI QOʻYILMA MC45 Foydalanuvchi qoʻllanmasi 72E-164159-01EN Rev. B Yanvar 2013 ii MC45 Foydalanuvchi qo‘llanmasi Ushbu nashrning hech bir qismini Motorola kompaniyasining yozma ruxsatisiz har qanday shaklda yoki elektr yoki mexanik vositalar yordamida qayta ishlab chiqarish yoki ishlatish mumkin emas. Bunga elektron yoki mexanik nusxa ko‘chirish yoki yozish qurilmalari, shuningdek, axborotni saqlash va qidirish qurilmalari kiradi...”. “Ish dasturi quyidagilar asosida ishlab chiqilgan: 1. 04.05.2000 yilda tasdiqlangan 560800 Agroinjeneriya bakalavriat yoʻnalishi boʻyicha Oliy kasbiy taʼlimning Federal davlat taʼlim standarti (roʻyxatga olish raqami 313 s/bak). 2. Mashina nazariyasi asoslari fanining taxminiy dasturi, 2001 yil 27 iyunda tasdiqlangan. 3. Universitet ilmiy kengashining 22.04.13 yildagi № 4-sonli qarori bilan tasdiqlangan ishchi oʻquv rejasi. Etakchi oʻqituvchi: Ablikov V.A., professor. _ Ablikov 16.06.13 Oʻqituvchilar: Ablikov V.A., professor _ Ablikov 16.06.13 Soxta K.A., professor _...” "Rossiya Federatsiyasi Qishloq xo'jaligi vazirligi Federal davlat byudjeti oliy kasbiy ta'lim muassasasi V.P. nomidagi Moskva davlat qishloq xo'jaligi muhandislik universiteti. Goryachkina MOSHINALARNI TA’MIRLASH VA ISHONCHLIK KAFEDRASI Tasdiqlangan: Sirtqi ta’lim fakulteti dekani P.A. Silaichev “_” _ 2013 yil ISH DASTURI 190601-Avtomobillar va avtomobilsozlik mutaxassisligi 653300-yo’l transporti ixtisosligi. |
Bioorganik kimyo - hayot jarayonlarida ishtirok etuvchi moddalarning tuzilishi va xossalarini ularning biologik funktsiyalarini bilish bilan bevosita bog'liq holda o'rganadigan fan.
Bioorganik kimyo - biologik ahamiyatga ega birikmalarning tuzilishi va reaktivligini o'rganadigan fan. Bioorganik kimyo fanining predmeti biopolimerlar va bioregulyatorlar hamda ularning tuzilish elementlari hisoblanadi.
Biopolimerlarga oqsillar, polisaxaridlar (uglevodlar) va nuklein kislotalar kiradi. Bu guruh shuningdek, BMC bo'lmagan lipidlarni ham o'z ichiga oladi, lekin odatda organizmdagi boshqa biopolimerlar bilan bog'liq.
Bioregulyatorlar metabolizmni kimyoviy tartibga soluvchi birikmalardir. Bularga vitaminlar, gormonlar va ko'plab sintetik birikmalar, jumladan, dorivor moddalar kiradi.
Bioorganik kimyo organik kimyoning g'oyalari va usullariga asoslanadi.
Organik kimyoning umumiy tamoyillarini bilmasdan bioorganik kimyoni o'rganish qiyin. Bioorganik kimyo biologiya, biologik kimyo va tibbiy fizika bilan chambarchas bog'liq.
Organizm sharoitida sodir bo'ladigan reaktsiyalar to'plami deyiladi metabolizm.
Metabolizm jarayonida hosil bo'lgan moddalar deyiladi - metabolitlari.
Metabolizm ikki yo'nalishga ega:
Katabolizm - bu murakkab molekulalarning oddiyroqlarga bo'linishi reaktsiyasi.
Anabolizm - energiya yordamida oddiy moddalardan murakkab molekulalarni sintez qilish jarayoni.
Biosintez atamasi IN VIVO (tanada), IN VITRO (tanadan tashqari) kimyoviy reaksiyaga nisbatan qo'llaniladi.
Antimetabolitlar mavjud - biokimyoviy reaktsiyalarda metabolitlarning raqobatchilari.
Konjugatsiya molekulalarning barqarorligini oshirish omili sifatida. Organik birikmalar molekulalarida atomlarning o'zaro ta'siri va uni uzatish usullari
Ma'ruza mazmuni:
Juftlik va uning turlari:
p, p - juftlashtirish,
r,p - konjugatsiya.
Konjugatsiya energiyasi.
Ochiq zanjirli bog'langan tizimlar.
A vitamini, karotinlar.
Radikal va ionlarda konjugatsiya.
Birlashtirilgan yopiq elektron tizimlar. Aromatiklik, aromatiklik mezonlari, geterosiklik aromatik birikmalar.
Kovalent bog'lanish: qutbsiz va qutbli.
Induktiv va mezomer effektlar. EA va ED o'rinbosar hisoblanadi.
Organik kimyoda kimyoviy bog'lanishning asosiy turi kovalent bog'lanishdir. Organik molekulalarda atomlar s va p bog'lari bilan bog'langan.
Organik birikmalar molekulalaridagi atomlar kovalent bog'lar orqali bog'langan bo'lib, ular s va p bog'lar deb ataladi.

SP 3 dagi yagona s - bog'lanish - gibridlangan holat l - uzunlik (C-C 0,154 nm), E-energiya (83 kkal/mol), qutblanish va qutblanish qobiliyati bilan tavsiflanadi. Masalan:

Qo'sh bog'lanish to'yinmagan birikmalarga xos bo'lib, ularda markaziy s-bog'dan tashqari s-bog'ga perpendikulyar qoplama ham mavjud bo'lib, u p-bog' deb ataladi).
Qo'sh bog'lanishlar lokalizatsiya qilinadi, ya'ni elektron zichligi bog'langan atomlarning faqat 2 yadrosini qamrab oladi.

Ko'pincha siz va men shug'ullanamiz konjugatsiyalangan tizimlari. Agar qo'sh bog'lar bitta bog'lar bilan almashinsa (va umumiy holatda, qo'sh bog' bilan bog'langan atom p-orbitalga ega bo'lsa, u holda qo'shni atomlarning p-orbitallari bir-birining ustiga chiqib, umumiy p-elektron tizimini tashkil qilishi mumkin). Bunday tizimlar deyiladi konjugatsiyalangan yoki delokalizatsiyalangan . Masalan: butadien-1,3

p, p - konjugat tizimlar
Butadiendagi barcha atomlar SP 2 gibridlangan holatda va bir tekislikda yotadi (Pz gibrid orbital emas). Rz - orbitallar bir-biriga parallel. Bu ularning bir-biriga mos kelishi uchun sharoit yaratadi. Pz orbitalining bir-birining ustiga chiqishi C-1 va C-2 va C-3 va C-4, shuningdek C-2 va C-3 o'rtasida sodir bo'ladi, ya'ni u delokalizatsiya qilingan kovalent bog'lanish. Bu molekuladagi bog'lanish uzunligining o'zgarishida namoyon bo'ladi. C-1 va C-2 orasidagi bog'lanish uzunligi bitta bog'lanish bilan solishtirganda ko'paytiriladi va C-2 va C-3 o'rtasida qisqartiriladi.
l-C -S, 154 nm l S=S 0,134 nm
l S-N 1,147 nm l S =O 0,121 nm

r, p - juftlashtirish
P, p konjugatsiyalangan sistemaga peptid bog'lanish misol bo'la oladi.

r, p - konjugat sistemalar
C=0 qo'sh bog'lanish odatdagi uzunlik 0,121 ga nisbatan 0,124 nm gacha uzaytiriladi va C-N aloqasi oddiy holatda 0,147 nmga nisbatan qisqaradi va 0,132 nm ga aylanadi. Ya'ni elektron delokalizatsiya jarayoni bog'lar uzunliklarining tenglashishiga va molekulaning ichki energiyasini pasayishiga olib keladi. Biroq, r,p - konjugatsiya asiklik birikmalarda, faqat bitta C-C bog'lari bilan = bog'langanda emas, balki geteroatom bilan almashganda ham sodir bo'ladi:

Erkin p-orbitali bo'lgan X atomi qo'sh bog'ning yonida joylashgan bo'lishi mumkin. Ko'pincha bular O, N, S geteroatomlari va ularning p-orbitallari bo'lib, p-bog'lar bilan o'zaro ta'sir qiladi, p, p-konjugatsiyani hosil qiladi.
Masalan:
CH 2 = CH – O – CH = CH 2
Konjugatsiya nafaqat neytral molekulalarda, balki radikallar va ionlarda ham sodir bo'lishi mumkin:

Yuqoridagilarga asoslanib, ochiq tizimlarda juftlash quyidagi sharoitlarda sodir bo'ladi:
Konjugatsiyalangan tizimda ishtirok etuvchi barcha atomlar SP 2 - gibridlangan holatda.
Pz - barcha atomlarning orbitallari s-skelet tekisligiga perpendikulyar, ya'ni bir-biriga parallel.
Konjugatsiyalangan ko'p markazli tizim hosil bo'lganda, bog'lanish uzunligi tenglashadi. Bu erda "sof" bitta va ikki tomonlama aloqalar yo'q.
Konjugatsiyalangan tizimda p-elektronlarning delokalizatsiyasi energiyaning chiqishi bilan birga keladi. Tizim pastroq energiya darajasiga o'tadi, yanada barqaror, barqaror bo'ladi. Shunday qilib, butadien - 1,3 holatida konjugatsiyalangan tizimning shakllanishi 15 kJ/mol miqdorida energiyaning chiqishiga olib keladi. Aynan konjugatsiya tufayli allilik tipdagi ion radikallarining barqarorligi va ularning tabiatda tarqalishi ortadi.
Konjugatsiya zanjiri qancha uzun bo'lsa, uning hosil bo'lish energiyasi shunchalik ko'p bo'ladi.
Bu hodisa biologik muhim birikmalarda ancha keng tarqalgan. Masalan:


Tabiatda keng tarqalgan bir qator ion va molekulalarni o'z ichiga olgan bioorganik kimyo kursida molekulalar, ionlar va radikallarning termodinamik barqarorligi masalalariga doimo duch kelamiz. Masalan: 
Yopiq konturli ulangan tizimlar
Xushbo'ylik. Siklik molekulalarda ma'lum sharoitlarda konjugatsiyalangan tizim paydo bo'lishi mumkin. P, p - konjugatsiyalangan tizimga misol sifatida benzolni keltirish mumkin, bu erda p - elektron buluti uglerod atomlarini qoplaydi, bunday tizim deyiladi - aromatik.
Benzolda konjugatsiya natijasida energiya ortishi 150,6 kJ/mol ni tashkil qiladi. Shuning uchun benzol 900 o S haroratgacha termal barqarordir.
Yopiq elektron halqa mavjudligi NMR yordamida isbotlangan. Agar benzol molekulasi tashqi magnit maydonga joylashtirilsa, induktiv halqali oqim paydo bo'ladi.
Shunday qilib, Gyuckel tomonidan ishlab chiqilgan aromatiklik mezoni:
molekula tsiklik tuzilishga ega;
barcha atomlar SP 2 - gibridlangan holatda;
4n + 2 elektronni o'z ichiga olgan delokalizatsiyalangan p - elektron tizimi mavjud, bu erda n - davrlar soni.
Masalan: 
Bioorganik kimyoda alohida o'rinni savol egallaydi geterotsiklik birikmalarning aromatikligi.
Geteroatomlar (azot, oltingugurt, kislorod) bo'lgan tsiklik molekulalarda uglerod atomlarining p-orbitallari va geteroatom ishtirokida yagona p-elektron buluti hosil bo'ladi.
Besh a'zoli geterotsiklik birikmalar

Aromatik tizim 2 ta elektronni o'z ichiga olgan geteroatomning 4 ta p-orbitali C va bitta orbitalning o'zaro ta'siridan hosil bo'ladi. Oltita p elektron aromatik skelet hosil qiladi. Bunday konjuge tizim elektron ortiqcha hisoblanadi. Pirolda N atomi SP 2 gibridlangan holatda bo'ladi.
Pirol ko'plab biologik muhim moddalarning bir qismidir. To'rtta pirol halqasi porfinni hosil qiladi, aromatik tizim 26 p - elektron va yuqori konjugatsiya energiyasi (840 kJ / mol)
Porfin tuzilishi gemoglobin va xlorofillning bir qismidir 

Olti a'zoli geterotsiklik birikmalar
Bu birikmalar molekulalaridagi aromatik sistema uglerod atomlarining beshta p-orbitali va azot atomining bir p-orbitalining oʻzaro taʼsiridan hosil boʻladi. Ikkita SP 2 orbitalidagi ikkita elektron halqaning uglerod atomlari bilan s - bog'lanish hosil bo'lishida ishtirok etadi. Bir elektronli P orbitali aromatik skeletga kiradi. SP 2 - s-skelet tekisligida yolg'iz juft elektronga ega orbital yotadi.
Pirimidindagi elektron zichligi N ga siljiydi, ya'ni sistemada p - elektronlar kamaygan, u elektron yetishmaydi.
Ko'pgina geterotsiklik birikmalar bir yoki bir nechta geteroatomlarni o'z ichiga olishi mumkin 
Pirol, pirimidin va purin yadrolari ko'plab biologik faol molekulalarning bir qismidir.
Organik birikmalar molekulalarida atomlarning o'zaro ta'siri va uni uzatish usullari
Yuqorida aytib o'tilganidek, organik birikmalar molekulalaridagi bog'lanishlar s va p bog'lanishlari tufayli amalga oshiriladi; elektron zichligi bog'langan atomlar o'rtasida teng taqsimlanadi, agar bu atomlar bir xil yoki elektronegativlikka yaqin bo'lsa. Bunday ulanishlar deyiladi qutbsiz. 
CH 3 -CH 2 →CI qutb aloqasi
Ko'pincha organik kimyoda biz qutbli aloqalar bilan shug'ullanamiz.
Agar elektron zichligi ko'proq elektron manfiy atom tomon siljigan bo'lsa, unda bunday bog'lanish qutbli deb ataladi. Bog'lanish energiyasining qiymatlariga asoslanib, amerikalik kimyogari L. Pauling atomlarning elektron manfiyligining miqdoriy tavsifini taklif qildi. Quyida Pauling shkalasi keltirilgan.
Na Li H S C J Br Cl N O F
0,9 1,0 2,1 2,52,5 2,5 2,8 3,0 3,0 3,5 4,0
Gibridlanishning turli holatlaridagi uglerod atomlari elektromanfiyligi bilan farqlanadi. Shuning uchun s - SP 3 va SP 2 gibridlangan atomlar orasidagi bog'lanish - qutbli. 
Induktiv ta'sir
Elektron zichligining elektrostatik induksiya mexanizmi orqali s-bog'lar zanjiri bo'ylab uzatilishi deyiladi. induksiya orqali, effekt deyiladi induktiv va J bilan belgilanadi. J ning ta'siri, qoida tariqasida, uchta bog'lanish orqali zaiflashadi, lekin yaqin joylashgan atomlar yaqin atrofdagi dipolning ancha kuchli ta'sirini boshdan kechiradi.
Elektron zichligini s-bog' zanjiri bo'ylab o'z yo'nalishi bo'yicha siljituvchi o'rinbosarlar -J - effektini va aksincha +J effektini ko'rsatadi. 

Izolyatsiya qilingan p-bog', shuningdek, ochiq yoki yopiq konjugatsiyalangan tizimning bitta p-elektron buluti EA va ED o'rnini bosuvchi moddalar ta'sirida osongina qutblanishi mumkin. Bunday hollarda induktiv effekt p-bog'lanishga o'tadi, shuning uchun Jp bilan belgilanadi. 
Mezomerik effekt (konjugatsiya effekti)
Konjugatsiyalangan sistema a'zosi bo'lgan o'rinbosar ta'sirida elektron zichligining qayta taqsimlanishi deyiladi. mezomerik effekt(M-effekt). 
O‘rinbosar konjugatsiyalangan sistemaning bir qismi bo‘lishi uchun u qo‘sh bog‘ga (p,p konjugatsiya) yoki yolg‘iz juft elektronga ega geteroatomga (r,p konjugatsiya) ega bo‘lishi kerak. M - effekt zaiflashmasdan birlashtirilgan tizim orqali uzatiladi.
Konjugatsiyalangan sistemada elektron zichligini kamaytiruvchi (o‘z yo‘nalishi bo‘yicha joy almashgan elektron zichligi) o‘rinbosarlar -M effektini, konjugatsiyalangan sistemada elektron zichligini oshiruvchi o‘rinbosarlar esa +M effektini namoyon qiladi.
O'rinbosarlarning elektron effektlari 
Organik moddalarning reaktivligi ko'p jihatdan J va M ta'sirining tabiatiga bog'liq. Elektron effektlarning nazariy imkoniyatlarini bilish bizga ma'lum kimyoviy jarayonlarning borishini taxmin qilish imkonini beradi.
Organik birikmalarning kislota-asos xossalari Organik reaksiyalarning tasnifi.
Ma'ruza konspekti
Substrat, nukleofil, elektrofil haqida tushuncha.
Organik reaksiyalarning tasnifi.
qaytarilmas va qaytarilmas
radikal, elektrofil, nukleofil, sinxron.
mono- va bimolekulyar
almashtirish reaktsiyalari
qo'shilish reaktsiyalari
bartaraf etish reaktsiyalari
oksidlanish va qaytarilish
kislota-asos o'zaro ta'siri
Reaksiyalar regioselektiv, kimyoselektiv, stereoselektivdir.
Elektrofil qo'shilish reaktsiyalari. Morkovnikov hukmronligi, Morkovnikovning qo'shilishi.
Elektrofil almashtirish reaksiyalari: 1 va 2 turdagi orientantlar.
Organik birikmalarning kislota-asos xossalari.
Bronsted kislotalilik va asoslilik
Lyuis kislotaliligi va asosliligi
Qattiq va yumshoq kislotalar va asoslar nazariyasi.
Organik reaksiyalarning tasnifi
Organik reaksiyalarni sistemalashtirish bu reaksiyalarning xilma-xilligini nisbatan kam sonli turlarga kamaytirish imkonini beradi. Organik reaktsiyalarni quyidagilarga bo'lish mumkin:
tomon: qaytarilmas va qaytarilmas
substrat va reagentdagi bog'lanishlarning o'zgarishi tabiatiga ko'ra.
Substrat- yangi aloqa hosil qilish uchun uglerod atomini ta'minlovchi molekula
Reaktiv- substratga ta'sir qiluvchi birikma.
Substrat va reagentdagi bog'lanishlarning o'zgarishi tabiatiga ko'ra reaktsiyalarni quyidagilarga bo'lish mumkin:
radikal R
elektrofil E
nukleofil N(Y)
sinxron yoki muvofiqlashtirilgan 

SR reaksiyalarining mexanizmi
Boshlash
Zanjirning o'sishi
Ochiq kontur 
Yakuniy NATIJA BO'YICHA TASNIFI
Reaksiyaning yakuniy natijasiga muvofiqligi:
A) almashtirish reaksiyalari
B) qo‘shilish reaksiyalari
B) bartaraf etish reaksiyalari
D) qayta guruhlash
D) oksidlanish va qaytarilish
E) kislota-asos o'zaro ta'siri
Reaksiyalar ham sodir bo'ladi:
Regioselektiv– bir nechta reaksiya markazlaridan biri orqali oqishi ma’qul.
Kimyoselektiv- tegishli funktsional guruhlardan biri uchun imtiyozli reaktsiya.
Stereoselektiv- bir nechta stereoizomerlardan birining imtiyozli shakllanishi.
Alkenlar, alkanlar, alkadienlar, arenlar va geterosiklik birikmalarning reaktivligi
Organik birikmalarning asosini uglevodorodlar tashkil qiladi. Biz faqat biologik sharoitda va shunga mos ravishda uglevodorodlarning o'zlari bilan emas, balki uglevodorod radikallari ishtirokida amalga oshiriladigan reaktsiyalarni ko'rib chiqamiz.
Toʻyinmagan uglevodorodlarga alkenlar, alkadienlar, alkinlar, sikloalkenlar va aromatik uglevodorodlar kiradi. Ular uchun birlashtiruvchi printsip p - elektron bulutdir. Dinamik sharoitda organik birikmalar ham E+ tomonidan hujumga uchraydi
Biroq, alkinlar va arenlarning reagentlar bilan o'zaro ta'sir qilish reaktsiyalari turli natijalarga olib keladi, chunki bu birikmalarda p - elektron bulutining tabiati har xil: mahalliylashtirilgan va delokalizatsiyalangan.
Reaksiya mexanizmlarini ko'rib chiqishni A E reaktsiyalari bilan boshlaymiz. Ma'lumki, alkenlar bilan o'zaro ta'sir qiladi 
Gidratsiya reaksiyasining mexanizmi
Markovnikov qoidasiga ko'ra - umumiy formula HX assimetrik birikmalarning to'yinmagan uglevodorodlarga qo'shilishi - agar o'rnini bosuvchi ED bo'lsa, eng vodorodlangan uglerod atomiga vodorod atomi qo'shiladi. Anti-Markovnikov qo'shilishida, agar o'rnini bosuvchi EA bo'lsa, eng kam vodorodlanganga vodorod atomi qo'shiladi.
Aromatik tizimlardagi elektrofil o'rnini bosish reaktsiyalari o'ziga xos xususiyatlarga ega. Birinchi xususiyat shundaki, termodinamik jihatdan barqaror aromatik tizim bilan o'zaro ta'sir qilish uchun odatda katalizatorlar yordamida hosil bo'ladigan kuchli elektrofillar kerak.
Reaktsiya mexanizmi S E 

YO'NALISH TA'SIRI
O'rinbosar
Agar aromatik halqada biron bir o'rinbosar bo'lsa, u albatta halqaning elektron zichligi taqsimotiga ta'sir qiladi. ED - o'rnini bosuvchi moddalar (1-qatorning orientantlari) CH 3, OH, OR, NH 2, NR 2 - almashtirilmagan benzolga nisbatan almashtirishni osonlashtiradi va kiruvchi guruhni orto- va para-pozitsiyaga yo'naltiradi. Agar ED o'rnini bosuvchi moddalar kuchli bo'lsa, unda katalizator kerak emas, bu reaktsiyalar 3 bosqichda davom etadi.
EA o'rnini bosuvchi moddalar (ikkinchi turdagi orientantlar) almashtirilmagan benzolga nisbatan elektrofil almashtirish reaktsiyalariga to'sqinlik qiladi. SE reaktsiyasi yanada qattiqroq sharoitlarda sodir bo'ladi; kiruvchi guruh meta-pozitsiyaga kiradi. II turdagi o'rinbosarlarga quyidagilar kiradi:
COOH, SO 3 H, CHO, galogenlar va boshqalar.
SE reaksiyalari geterosiklik uglevodorodlar uchun ham xosdir. Pirol, furan, tiofen va ularning hosilalari p-ortiqcha tizimlarga kiradi va SE reaksiyalariga juda oson kiradi. Ular oson halogenlanadi, alkillanadi, asillanadi, sulfonlanadi va nitratlanadi. Reagentlarni tanlashda ularning kuchli kislotali muhitda beqarorligini, ya'ni atsidofobikligini hisobga olish kerak.
Piridin azot atomiga ega piridin va boshqa geterotsiklik tizimlar p-yetarli bo'lmagan tizimlar bo'lib, ular SE reaktsiyalariga kirishi ancha qiyinroq va kiruvchi elektrofil azot atomiga nisbatan b-o'rinni egallaydi. 
Organik birikmalarning kislotali va asosiy xossalari
Organik birikmalar reaktivligining eng muhim jihatlari organik birikmalarning kislota-ishqor xossalaridir.
Kislotalik va asoslilik shuningdek, organik birikmalarning ko'plab funktsional fizik-kimyoviy va biologik xususiyatlarini belgilovchi muhim tushunchalar. Kislota va asos katalizi eng keng tarqalgan fermentativ reaktsiyalardan biridir. Zaif kislotalar va asoslar metabolizm va uni tartibga solishda muhim rol o'ynaydigan biologik tizimlarning umumiy tarkibiy qismlaridir.
Organik kimyoda kislotalar va asoslar haqida bir qancha tushunchalar mavjud. Noorganik va organik kimyoda umumiy qabul qilingan kislotalar va asoslarning Bronsted nazariyasi. Bronstedning fikricha, kislotalar proton berishi mumkin bo'lgan moddalar, asoslar esa protonni qabul qila oladigan moddalardir. 
Bronted kislotalilik
Asosan, ko'pchilik organik birikmalarni kislotalar deb hisoblash mumkin, chunki organik birikmalarda H C, N O S bilan bog'langan.
Organik kislotalar mos ravishda C - H, N - H, O - H, S-H - kislotalarga bo'linadi. 


Kislotalik Ka yoki - log Ka = pKa shaklida baholanadi, pKa qancha past bo'lsa, kislota kuchliroq bo'ladi.
Organik birikmalarning kislotaliligini miqdoriy baholash barcha organik moddalar uchun aniqlanmagan. Shuning uchun turli xil kislotali joylarning kislotali xususiyatlarini sifatli baholash qobiliyatini rivojlantirish muhimdir. Buning uchun umumiy uslubiy yondashuv qo'llaniladi.
Kislota kuchi anionning barqarorligi (konjugat asos) bilan belgilanadi. Anion qanchalik barqaror bo'lsa, kislota shunchalik kuchli bo'ladi.
Anionning barqarorligi bir qator omillarning kombinatsiyasi bilan belgilanadi:
kislota markazidagi elementning elektronegativligi va qutblanishi.
aniondagi manfiy zaryadning delokalizatsiya darajasi.
kislota markazi bilan bog'liq bo'lgan radikalning tabiati.
solvatsiya effektlari (erituvchining ta'siri)
Keling, ushbu omillarning barchasining rolini ketma-ket ko'rib chiqaylik:
Elementlarning elektromanfiyligining ta'siri
Elektromanfiy element qanchalik ko'p bo'lsa, zaryad shunchalik delokalizatsiyalangan va anion qanchalik barqaror bo'lsa, kislota shunchalik kuchli bo'ladi.
C (2,5) N (3,0) O (3,5) S (2,5)
Shuning uchun CH seriyasida kislotalilik o'zgaradi< NН < ОН SH kislotalari uchun yana bir omil ustunlik qiladi - polarizatsiya. Oltingugurt atomi hajmi jihatidan kattaroq va bo'sh d orbitallarga ega. shuning uchun manfiy zaryad katta hajmda delokalizatsiyaga qodir, bu esa anionning barqarorligini oshiradi. Tiollar kuchli kislotalar sifatida ishqorlar, shuningdek og'ir metallarning oksidlari va tuzlari bilan reaksiyaga kirishadi, spirtlar (zaif kislotalar) esa faqat faol metallar bilan reaksiyaga kirishadi. Tollarning nisbatan yuqori kislotaligi tibbiyotda va dorilar kimyosida qo'llaniladi. Masalan: As, Hg, Cr, Bi bilan zaharlanish uchun ishlatiladi, ularning ta'siri metallarni bog'lash va ularni tanadan olib tashlash bilan bog'liq. Masalan: Kislota markazida bir xil atomga ega birikmalarning kislotaliligini baholashda aniondagi manfiy zaryadning delokalizatsiyasi hal qiluvchi omil hisoblanadi. Anionning barqarorligi konjugatsiyalangan bog'lanishlar tizimi bo'ylab manfiy zaryadni delokalizatsiya qilish imkoniyati paydo bo'lishi bilan sezilarli darajada oshadi. Spirtli ichimliklar bilan solishtirganda fenollarda kislotalikning sezilarli darajada oshishi molekula bilan solishtirganda ionlarda delokalizatsiya ehtimoli bilan izohlanadi. Karboksilik kislotalarning yuqori kislotaliligi karboksilat anionining rezonans barqarorligi bilan bog'liq. Zaryadning delokalizatsiyasi elektronni tortib oluvchi o'rinbosarlarning (EA) mavjudligi bilan osonlashadi, ular anionlarni barqarorlashtiradi va shu bilan kislotalikni oshiradi. Masalan, EA molekulasiga o'rinbosarni kiritish O'rinbosar va erituvchining ta'siri a - gidroksi kislotalar tegishli karboksilik kislotalarga qaraganda kuchliroq kislotalardir. ED - o'rnini bosuvchi moddalar, aksincha, kislotalikni kamaytiradi. Anionning barqarorlashuviga erituvchilar ko'proq ta'sir qiladi, qoida tariqasida, zaryadsizlanish darajasi past bo'lgan kichik ionlar yaxshiroq solvatlanadi. Solvatsiyaning ta'sirini, masalan, qatorda kuzatish mumkin: Agar kislota markazidagi atom musbat zaryadga ega bo'lsa, bu kislotalikning oshishiga olib keladi. Tomoshabinlarga savol: qaysi kislota - sirka yoki palmitik C 15 H 31 COOH - pastroq pKa qiymatiga ega bo'lishi kerak? Agar kislota markazidagi atom musbat zaryadga ega bo'lsa, bu kislotalikning oshishiga olib keladi. Elektrofil almashtirish reaksiyasida hosil bo'lgan s - kompleksning kuchli CH - kislotaligini qayd etish mumkin. Bronsted asoslilik Proton bilan bog'lanish uchun geteroatomda umumiy bo'lmagan elektron juftligi kerak, yoki anionlar bo'ladi. p-asoslari mavjud va p asoslar, bu erda asosiylik markazi lokalizatsiyalangan p bog'ning elektronlari yoki konjugatsiyalangan tizimning p elektronlari (p komponentlar) Baza kuchi kislotalilik bilan bir xil omillarga bog'liq, ammo ularning ta'siri aksincha. Atomning elektromanfiyligi qanchalik katta bo'lsa, u yolg'iz elektron juftligini shunchalik qattiq ushlab turadi va proton bilan bog'lanish uchun kamroq mavjud. Keyin, umuman olganda, bir xil o'rnini bosuvchi n-asoslarning kuchi ketma-ketlikda o'zgaradi: Eng asosiy organik birikmalar aminlar va spirtlardir: Mineral kislotalar bilan organik birikmalarning tuzlari yaxshi eriydi. Ko'pgina dorilar tuzlar shaklida qo'llaniladi. Bir molekulada kislota-asos markazi (amfoter) Vodorod aloqalari kislota-asos o'zaro ta'siri sifatida Barcha a - aminokislotalar uchun kuchli kislotali va kuchli ishqoriy muhitda anionli kation shakllari ustunlik qiladi. Zaif kislotali va asosli markazlarning mavjudligi zaif o'zaro ta'sirlarga - vodorod aloqalariga olib keladi. Masalan: past molekulyar og'irlikka ega imidazol vodorod bog'lari mavjudligi sababli yuqori qaynash nuqtasiga ega. J.Lyuis elektron qobiqlarning tuzilishiga asoslanib, kislotalar va asoslarning umumiyroq nazariyasini taklif qildi. Lyuis kislotasi bo'sh orbitaga ega bo'lgan atom, molekula yoki kation bo'lishi mumkin, ular bir juft elektronni bog'lanish uchun qabul qila oladi. Lyuis kislotalarining vakillari davriy sistemaning II va III guruhlari elementlarining galogenidlari D.I. Mendeleev. Lyuis asoslari bir juft elektronni berishga qodir atom, molekula yoki aniondir. Lyuis asoslariga aminlar, spirtlar, efirlar, tiollar, tioefirlar va p bog'langan birikmalar kiradi. Misol uchun, quyida keltirilgan o'zaro ta'sir Lyuis kislota-asos o'zaro ta'siri sifatida ifodalanishi mumkin Lyuis nazariyasining muhim natijasi shundaki, har qanday organik modda kislota-asos kompleksi sifatida ifodalanishi mumkin. Organik birikmalarda molekula ichidagi vodorod aloqalari molekulalararo bog'lanishlarga qaraganda kamroq uchraydi, lekin ular bioorganik birikmalarda ham uchraydi va ularni kislota-asos o'zaro ta'siri deb hisoblash mumkin. "Qattiq" va "yumshoq" tushunchalari kuchli va kuchsiz kislotalar va asoslar bilan bir xil emas. Bu ikkita mustaqil xususiyatdir. LCMO ning mohiyati shundaki, qattiq kislotalar qattiq asoslar bilan, yumshoq kislotalar esa yumshoq asoslar bilan reaksiyaga kirishadi. Pirsonning qattiq va yumshoq kislotalar va asoslar (HABP) printsipiga ko'ra, Lyuis kislotalari qattiq va yumshoq bo'linadi. Qattiq kislotalar kichik o'lchamli, katta musbat zaryadli, yuqori elektromanfiy va past qutblanish qobiliyatiga ega bo'lgan qabul qiluvchi atomlardir. Yumshoq kislotalar kichik musbat zaryadga, past elektronegativlikka va yuqori qutblanishga ega bo'lgan yirik akseptor atomlardir.. LCMO ning mohiyati shundaki, qattiq kislotalar qattiq asoslar bilan, yumshoq kislotalar esa yumshoq asoslar bilan reaksiyaga kirishadi. Masalan: Organik birikmalarning oksidlanishi va qaytarilishi Oksidlanish-qaytarilish reaktsiyalari hayotiy jarayonlar uchun katta ahamiyatga ega. Ularning yordami bilan organizm o'zining energiya ehtiyojlarini qondiradi, chunki organik moddalarning oksidlanishi energiyani chiqaradi. Boshqa tomondan, bu reaktsiyalar oziq-ovqatni hujayra tarkibiy qismlariga aylantirishga xizmat qiladi. Oksidlanish reaktsiyalari organizmdan dorilarni detoksifikatsiya qilish va olib tashlashga yordam beradi. Oksidlanish - bu bir nechta aloqa yoki yangi qutbli aloqalarni hosil qilish uchun vodorodni olib tashlash jarayoni. Qaytarilish oksidlanishning teskari jarayonidir. Organik substratlarning oksidlanishi osonroq kechsa, uning elektronlardan voz kechish tendentsiyasi shunchalik kuchli bo'ladi. Oksidlanish va qaytarilishni birikmalarning ma'lum sinflari bilan bog'liq holda hisobga olish kerak. C-H aloqalarining oksidlanishi (alkanlar va alkillar) Alkanlar to'liq yonganda CO 2 va H 2 O hosil bo'ladi va issiqlik chiqariladi. Ularni oksidlanish va qaytarilishning boshqa usullari quyidagi sxemalar bilan ifodalanishi mumkin: To'yingan uglevodorodlarning oksidlanishi og'ir sharoitlarda sodir bo'ladi (xrom aralashmasi issiq); yumshoq oksidlovchilar ularga ta'sir qilmaydi. Oraliq oksidlanish mahsulotlari spirtlar, aldegidlar, ketonlar va kislotalardir. R - O - OH gidroperoksidlari yumshoq sharoitlarda, xususan, in vivo sharoitida C - H aloqalarining oksidlanishining eng muhim oraliq mahsulotidir. Tana sharoitida C-H aloqalarining muhim oksidlanish reaktsiyasi fermentativ gidroksillanishdir. Misol tariqasida, oziq-ovqat mahsulotlarini oksidlash orqali spirtli ichimliklarni ishlab chiqarish mumkin. Molekulyar kislorod va uning faol shakllari tufayli. in vivo amalga oshiriladi. Vodorod periks organizmda gidroksillovchi vosita sifatida xizmat qilishi mumkin. Ortiqcha peroksid katalaza yordamida suv va kislorodga parchalanishi kerak. Alkenlarning oksidlanishi va qaytarilishi quyidagi o'zgarishlar bilan ifodalanishi mumkin: Alkenlarning qisqarishi Aromatik uglevodorodlarning oksidlanishi va qaytarilishi Benzolni hatto og'ir sharoitlarda ham quyidagi sxema bo'yicha oksidlash juda qiyin: Oksidlanish qobiliyati benzoldan naftalinga va undan keyin antrasenga sezilarli darajada oshadi. ED o'rnini bosuvchi moddalar aromatik birikmalarning oksidlanishini osonlashtiradi. EA - oksidlanishga to'sqinlik qiladi. Benzolning tiklanishi. C 6 H 6 + 3 H 2 Aromatik birikmalarning fermentativ gidroksillanishi Spirtli ichimliklarni oksidlanishi Uglevodorodlar bilan solishtirganda, spirtlarning oksidlanishi yumshoqroq sharoitda sodir bo'ladi Tana sharoitida diollarning eng muhim reaktsiyasi xinon-gidrokinon tizimidagi transformatsiyadir. Elektronlarning substratdan kislorodga o'tishi metaxondriyalarda sodir bo'ladi. Aldegid va ketonlarning oksidlanishi va qaytarilishi Organik birikmalarning eng oson oksidlanadigan sinflaridan biri 2H 2 C = O + H 2 O CH 3 OH + HCOOH yorug'likda ayniqsa oson oqadi. Azot o'z ichiga olgan birikmalarning oksidlanishi Ominlar juda oson oksidlanadi, oksidlanishning yakuniy mahsuloti nitro birikmalardir Azot o'z ichiga olgan moddalarning to'liq kamayishi aminlarning paydo bo'lishiga olib keladi. In vivo aminlarning oksidlanishi Tiollarning oksidlanishi va qaytarilishi Organik birikmalarning O-B xossalarining qiyosiy tavsiflari. Tiollar va 2 atomli fenollar eng oson oksidlanadi. Aldegidlar juda oson oksidlanadi. Spirtli ichimliklarni oksidlanishi qiyinroq, birlamchilari esa ikkilamchi va uchinchi darajalilarga qaraganda osonroq. Ketonlar oksidlanishga chidamli yoki molekulaning parchalanishi bilan oksidlanadi. Alkinlar xona haroratida ham oson oksidlanadi. Oksidlanishning eng qiyinlari Sp3-gibridlangan holatdagi uglerod atomlarini o'z ichiga olgan birikmalar, ya'ni molekulalarning to'yingan bo'laklari. ED - o'rnini bosuvchi moddalar oksidlanishni osonlashtiradi EA - oksidlanishga to'sqinlik qiladi. Poli- va geterofunksional birikmalarning o'ziga xos xususiyatlari. Ma'ruza konspekti Poli- va geterofunksionallik organik birikmalarning reaktivligini oshiradigan omil sifatida. Poli- va geterofunksional birikmalarning o'ziga xos xususiyatlari: molekulyar tuzlarning amfoterlik hosil bo'lishi. g, d, e – geterofunksional birikmalarning molekula ichidagi sikllanishi. molekulalararo sikllanish (laktidlar va deketopipirozinlar) xelyatsiya. beta-heterofunksionalni yo'q qilish reaktsiyalari ulanishlar. keto-enol tautomeriyasi. Fosfoenolpiruvat, kabi makroergik birikma. dekarboksillanish. stereoizomerizm Poli- va geterofunksionallik gidroksi, aminokislota va okso kislotalarda o'ziga xos xususiyatlarning paydo bo'lishining sababi sifatida. Molekulada bir nechta bir xil yoki turli funktsional guruhlarning mavjudligi biologik muhim organik birikmalarga xos xususiyatdir. Molekula ikki yoki undan ortiq gidroksil guruhlari, aminokislotalar yoki karboksil guruhlarni o'z ichiga olishi mumkin. Masalan: Hayotiy faoliyatda ishtirok etadigan moddalarning muhim guruhi turli funktsional guruhlarning juft birikmasiga ega bo'lgan geterofunktsional birikmalardir. Masalan: Alifatik birikmalarda yuqoridagi barcha funksional guruhlar EA xarakterini namoyon qiladi. Ularning bir-biriga ta'siri tufayli ularning reaktivligi o'zaro kuchayadi. Masalan, oksokislotalarda ikkita karbonil uglerod atomining har birining elektrofilligi boshqa funksional guruhning -J tomonidan kuchayadi, bu esa nukleofil reagentlarning oson hujumiga olib keladi. I effekti 3-4 bog'lanishdan so'ng yo'qolganligi sababli, uglevodorod zanjiridagi funktsional guruhlarning joylashishining yaqinligi muhim holatdir. Geterofunksional guruhlar bir xil uglerod atomida (a - tartibga solish) yoki turli xil uglerod atomlarida, ikkala qo'shni (b joylashuv) va bir-biridan uzoqroq (g, delta, epsilon) joylarda joylashgan bo'lishi mumkin. Har bir geterofunktsional guruh o'zining reaktivligini saqlab qoladi, aniqrog'i, geterofunktsional birikmalar "ikki" sonidagi kimyoviy reaktsiyalarga kiradi. Geterofunksional guruhlarning o'zaro joylashishi etarlicha yaqin bo'lsa, ularning har birining reaktivligi o'zaro kuchayadi. Molekulada kislotali va asosiy guruhlarning bir vaqtning o'zida mavjudligi bilan birikma amfoterga aylanadi. Masalan: aminokislotalar. Geterofunksional guruhlarning o'zaro ta'siri Gerofunktsional birikmalar molekulasida bir-biri bilan ta'sir o'tkazishga qodir bo'lgan guruhlar bo'lishi mumkin. Masalan, amfoter birikmalarda, masalan, a-aminokislotalarda ichki tuzlarning hosil bo'lishi mumkin. Shuning uchun barcha a - aminokislotalar biopolyar ionlar shaklida bo'ladi va suvda yaxshi eriydi. Kislota-asos o'zaro ta'siridan tashqari, boshqa turdagi kimyoviy reaktsiyalar ham mumkin bo'ladi. Misol uchun, SP 2 da S N reaktsiyasi spirt guruhi bilan o'zaro ta'sir qilish, efirlarning hosil bo'lishi, aminokislotalarga ega bo'lgan karboksil guruhi (amidlarning hosil bo'lishi) tufayli karbonil guruhidagi uglerod atomining gibrididir. Funktsional guruhlarning nisbiy joylashishiga qarab, bu reaksiyalar bir molekula ichida (molekulyar) ham, molekulalar o'rtasida ham (molekulalararo) sodir bo'lishi mumkin. Chunki reaksiya natijasida siklik amidlar va efirlar hosil bo'ladi. keyin hal qiluvchi omil sikllarning termodinamik barqarorligiga aylanadi. Shu munosabat bilan, yakuniy mahsulot odatda olti a'zoli yoki besh a'zoli halqalarni o'z ichiga oladi. Molekulyar oʻzaro taʼsir besh yoki olti aʼzoli efir (amid) halqa hosil qilishi uchun geterofunksional birikma molekulada gamma yoki sigma joylashuviga ega boʻlishi kerak. Keyin sinfda Reja 1. Bioorganik kimyoning predmeti va ahamiyati 2. Organik birikmalarning tasnifi va nomenklaturasi 3. Organik molekulalarni tasvirlash usullari 4. Bioorganik molekulalardagi kimyoviy bog lanish 5. Elektron effektlar. Molekuladagi atomlarning o'zaro ta'siri 6. Kimyoviy reaksiyalar va reagentlarning tasnifi 7. Kimyoviy reaksiyalarning mexanizmlari haqida tushuncha 2.
Bioorganik kimyo fanining predmeti 3 Bioorganik kimyo - tirik organizmlar almashinuvida ishtirok etuvchi organik kelib chiqishi kimyoviy birikmalarining tuzilishi, xossalari va biologik funktsiyalarini o'rganadigan kimyo fanining mustaqil tarmog'i.
Bioorganik kimyoning oʻrganish obʼyektlari boʻlib past molekulyar biomolekulalar va biopolimerlar (oqsillar, nuklein kislotalar va polisaxaridlar), bioregulyatorlar (fermentlar, gormonlar, vitaminlar va boshqalar), tabiiy va sintetik fiziologik faol birikmalar, shu jumladan toksik taʼsir koʻrsatadigan dori vositalari va moddalardir. Biomolekulalar - tirik organizmlarning bir qismi bo'lgan bioorganik birikmalar bo'lib, hujayra tuzilmalarini shakllantirish va biokimyoviy reaktsiyalarda ishtirok etish uchun ixtisoslashgan, metabolizm (metabolizm) va tirik hujayralar va umuman ko'p hujayrali organizmlarning fiziologik funktsiyalarining asosini tashkil qiladi. 4 Bioorganik birikmalarning tasnifi
Metabolizm - bu organizmda sodir bo'ladigan kimyoviy reaktsiyalar yig'indisi (in vivo). Metabolizm metabolizm deb ham ataladi. Metabolizm ikki yo'nalishda - anabolizm va katabolizmda sodir bo'lishi mumkin. Anabolizm - bu nisbatan oddiy moddalardan murakkab moddalarning organizmda sintezi. Bu energiya sarflanishi (endotermik jarayon) bilan sodir bo'ladi. Katabolizm, aksincha, murakkab organik birikmalarning oddiyroqlarga bo'linishidir. Bu energiya chiqishi bilan sodir bo'ladi (ekzotermik jarayon). Metabolik jarayonlar fermentlar ishtirokida sodir bo'ladi. Fermentlar organizmda biokatalizator rolini o'ynaydi. Fermentlarsiz biokimyoviy jarayonlar yo umuman sodir bo'lmaydi, yoki juda sekin davom etadi va organizm hayotni saqlab qololmaydi. 5
Bioelementlar. Bioorganik birikmalar tarkibiga har qanday organik molekulaning asosini tashkil etuvchi uglerod atomlaridan (C) tashqari, vodorod (H), kislorod (O), azot (N), fosfor (P) va oltingugurt (S) ham kiradi. . Ushbu bioelementlar (organogenlar) tirik organizmlarda jonsiz narsalardagi tarkibidan 200 baravar ko'p miqdorda to'plangan. Belgilangan elementlar biomolekulalarning elementar tarkibining 99% dan ortig'ini tashkil qiladi. 6
Bioorganik kimyo organik kimyoning chuqurligidan vujudga kelgan va uning g'oyalari va usullariga asoslanadi. Rivojlanish tarixida organik kimyo quyidagi bosqichlarga ega: empirik, analitik, strukturaviy va zamonaviy. Insonning organik moddalar bilan birinchi tanishuvidan to 18-asr oxirigacha boʻlgan davr empirik hisoblanadi. Bu davrning asosiy natijasi shundaki, odamlar elementar tahlilning muhimligini va atom va molekulyar massalarni o'rnatishni angladilar. Vitalizm nazariyasi - hayot kuchi (Berzelius). Analitik davr 19-asrning 60-yillarigacha davom etdi. Bu 19-asrning birinchi choragi oxiridan boshlab vitalistik nazariyaga qattiq zarba bergan bir qator istiqbolli kashfiyotlar qilinganligi bilan ajralib turdi. Bu seriyaning birinchisi Berzeliusning shogirdi, nemis kimyogari Wöhler edi. U 1824 yilda bir qator kashfiyotlar qildi - siyanogendan oksalat kislota sintezi: (CN) 2 HOOC - COOH r. – ammoniy siyanatdan karbamid sintezi: NH 4 CNO NH 2 – C – NH 2 O 8
1853-yilda C.Jerard «turlar nazariyasi»ni ishlab chiqdi va undan organik birikmalarni tasniflashda foydalandi. Jerarning fikricha, quyidagi to'rtta asosiy turdagi moddalardan murakkabroq organik birikmalar olinishi mumkin: HHHH tipi HHHH O turi SUV H Cl tipi VODOD XLORIDI HHHHN N tipi AMMONIK 1857 yildan boshlab F. A. Kekule taklifi bilan uglevodorodlar tasniflana boshladi. metan turi HHHNNHH C 9 sifatida
Organik birikmalar tuzilishi nazariyasining asosiy qoidalari (1861) 1) molekulalardagi atomlar valentligiga muvofiq bir-biri bilan kimyoviy bog`lar orqali bog`langan; 2) organik moddalar molekulalaridagi atomlar bir-biri bilan ma'lum ketma-ketlikda bog'lanadi, bu molekulaning kimyoviy tuzilishini (strukturasini) belgilaydi; 3) organik birikmalarning xossalari nafaqat ularning tarkibidagi atomlarning soni va tabiatiga, balki molekulalarning kimyoviy tuzilishiga ham bog'liq; 4) organik molekulalarda bir-biriga bog'langan va bog'lanmagan atomlar o'rtasida o'zaro ta'sir mavjud; 5) moddaning kimyoviy tuzilishini uning kimyoviy o'zgarishlarini o'rganish orqali aniqlash mumkin va aksincha, uning xususiyatlarini moddaning tuzilishi bilan tavsiflash mumkin. 10
Organik birikmalar tuzilishi nazariyasining asosiy qoidalari (1861) Strukturaviy formula - molekuladagi atomlarning bog'lanish ketma-ketligi tasviridir. Yalpi formula - CH 4 O yoki CH 3 OH Strukturaviy formula Soddalashtirilgan struktura formulalari ba'zan ratsional deb ataladi Molekulyar formula - molekuladagi har bir element atomlari sonini ko'rsatadigan organik birikma formulasi. Masalan: C 5 H 12 - pentan, C 6 H 6 - benzin va boshqalar. o'n bir
Bioorganik kimyoning rivojlanish bosqichlari Bir tomondan organik kimyoning kontseptual tamoyillari va metodologiyasini, ikkinchi tomondan molekulyar biokimyo va molekulyar farmakologiyani o'zida mujassam etgan alohida bilim sohasi sifatida bioorganik kimyo XX asrda bioorganik kimyoning rivojlanishi asosida shakllandi. tabiiy moddalar va biopolimerlar kimyosi. Zamonaviy bioorganik kimyo V. Shtayn, S. Mur, F. Sanger (aminokislotalar tarkibini tahlil qilish va peptidlar va oqsillarning birlamchi tuzilishini aniqlash), L. Poling va X. Astberi (aniqlash) ishlari tufayli fundamental ahamiyatga ega bo'ldi. -spiral va -struktura tuzilishi va ularning oqsil molekulalarining biologik funksiyalarini amalga oshirishdagi ahamiyati, E.Chargaff (nuklein kislotalarning nukleotid tarkibining xususiyatlarini dekodlash), J.Uotson, Fr. Krik, M. Uilkins, R. Franklin (DNK molekulasining fazoviy tuzilishining qonuniyatlarini o'rnatish), G. Korani (kimyoviy gen sintezi) va boshqalar. 14
Organik birikmalarning uglerod skeletining tuzilishi va funktsional guruh tabiatiga ko'ra tasnifi Organik birikmalarning ko'pligi kimyogarlarni ularni tasniflashga undadi. Organik birikmalarni tasniflash ikkita tasnif mezoniga asoslanadi: 1. Uglerod skeletining tuzilishi 2. Funksional guruhlarning tabiati Uglerod skeletining tuzilishi usuliga ko ra tasnifi: 1. Asiklik (alkanlar, alkenlar, alkinlar, alkadienlar); 2. Tsiklik 2.1. Karbotsiklik (alitsiklik va aromatik) 2.2. Geterotsiklik 15 Tsiklik birikmalar alifatik deb ham ataladi. Bularga ochiq uglerod zanjiri bo'lgan moddalar kiradi. Asiklik birikmalar to'yingan (yoki to'yingan) C n H 2n+2 (alkanlar, parafinlar) va to'yinmagan (to'yinmagan) ga bo'linadi. Ikkinchisiga alkenlar C n H 2n, alkinlar C n H 2n -2, alkadienlar C n H 2n -2 kiradi.
16 Tsiklik birikmalar molekulalari ichida halqalarni (sikllarni) o'z ichiga oladi. Agar tsikllarda faqat uglerod atomlari bo'lsa, unda bunday birikmalar karbotsiklik deyiladi. O'z navbatida, karbotsiklik birikmalar alitsiklik va aromatiklarga bo'linadi. Alitsiklik uglevodorodlarga (sikloalkanlarga) siklopropan va uning gomologlari - siklobutan, siklopentan, siklogeksan va boshqalar kiradi. Agar siklik tizimga uglevodoroddan tashqari boshqa elementlar ham kirsa, bunday birikmalar geterosiklik deb tasniflanadi.
Funktsional guruhning tabiati bo'yicha tasnifi Funktsional guruh - bu ma'lum bir tarzda bog'langan atom yoki atomlar guruhi bo'lib, ularning organik moddalar molekulasida mavjudligi xarakterli xususiyatlarni va uning u yoki bu birikmalar sinfiga tegishliligini belgilaydi. . Funktsional guruhlarning soni va bir jinsliligiga qarab, organik birikmalar mono-, poli- va geterofunksionallarga bo'linadi. Bir funktsional guruhga ega bo'lgan moddalar monofunksional deyiladi, bir nechta bir xil funktsional guruhlarga ega bo'lgan moddalar ko'p funktsional deyiladi. Bir nechta turli funktsional guruhlarni o'z ichiga olgan birikmalar geterofunksionaldir. Xuddi shu sinfdagi birikmalarning gomologik qatorlarga birlashtirilishi muhim. Gomologik qator - bir xil funktsional guruhlarga va bir xil tuzilishga ega bo'lgan organik birikmalar qatori; gomologik qatorning har bir vakili oldingisidan doimiy birlik (CH 2) bilan farqlanadi, bu gomologik farq deb ataladi. Gomologik qator a'zolari gomologlar deyiladi. 17
Organik kimyoda nomenklatura tizimlari - trivial, ratsional va xalqaro (IUPAC) Kimyoviy nomenklatura - bu alohida kimyoviy moddalarning nomlari, ularning guruhlari va sinflari, shuningdek ularning nomlarini tuzish qoidalari Kimyoviy nomenklatura - bu alohida kimyoviy moddalar nomlari to'plami. moddalar, ularning guruhlari va sinflari, shuningdek ularning nomlarini tuzuvchi qoidalar. Arzimas (tarixiy) nomenklatura moddalarni olish jarayoni (pirogallol - gallat kislotasining piroliz mahsuloti), u olingan manba (chumoli kislotasi) va boshqalar bilan bog'liq. Birikmalarning trivial nomlari tabiiy va geterotsiklik birikmalar kimyosida (sitral, geraniol, tiofen, pirrol, xinolin va boshqalar) keng qo'llaniladi.Trivial (tarixiy) nomenklatura moddalarni olish jarayoni bilan bog'liq (pirogallol piroliz mahsuloti). gallik kislotasi), kelib chiqish manbai, undan olingan (chumoli kislotasi) va boshqalar. Birikmalarning arzimas nomlari tabiiy va geterotsiklik birikmalar (sitral, geraniol, tiofen, pirrol, xinolin va boshqalar) kimyosida keng qo'llaniladi. Ratsional nomenklatura organik birikmalarni gomologik qatorlarga bo'lish tamoyiliga asoslanadi. Ma'lum bir gomologik qatordagi barcha moddalar ushbu seriyaning eng oddiy vakili - birinchi yoki ba'zan ikkinchisining hosilalari deb hisoblanadi. Xususan, alkanlar uchun - metan, alkenlar uchun - etilen va boshqalar Ratsional nomenklatura organik birikmalarni gomologik qatorlarga bo'lish tamoyiliga asoslanadi. Ma'lum bir gomologik qatordagi barcha moddalar ushbu seriyaning eng oddiy vakili - birinchi yoki ba'zan ikkinchisining hosilalari deb hisoblanadi. Xususan, alkanlar uchun - metan, alkenlar uchun - etilen va boshqalar. 18
Xalqaro nomenklatura (IUPAC). Zamonaviy nomenklatura qoidalari 1957 yilda Xalqaro sof va amaliy kimyo ittifoqining (IUPAC) 19-kongressida ishlab chiqilgan. Radikal funksional nomenklatura. Bu nomlar funktsional sinf nomiga (spirt, efir, keton va boshqalar) asoslanadi, undan oldin uglevodorod radikallari nomlari keladi, masalan: allilxlorid, dietil efir, dimetil keton, propil spirti va boshqalar. Nomenklaturani almashtirish. Nomenklatura qoidalari. Ota-ona tuzilmasi - bu birikma nomi ostida joylashgan molekulaning (molekulyar skeletning) strukturaviy qismi, alitsiklik birikmalar uchun atomlarning asosiy uglerod zanjiri va karbotsiklik birikmalar uchun tsikl. 19
Organik molekulalardagi kimyoviy bog'lanish Kimyoviy bog'lanish tashqi elektron qobiqlar (atomlarning valent elektronlari) va atom yadrolari o'rtasidagi o'zaro ta'sir hodisasi bo'lib, u butun molekula yoki kristalning mavjudligini belgilaydi. Qoidaga ko'ra, elektronni qabul qiladigan yoki beradigan yoki umumiy elektron juftligini hosil qiluvchi atom tashqi elektron qobig'ining asil gazlar konfiguratsiyasiga o'xshash konfiguratsiyaga ega bo'lishga intiladi. Kimyoviy bog'lanishning quyidagi turlari organik birikmalar uchun xarakterlidir: - ionli bog' - kovalent bog' - donor - akseptor bog' - vodorod bog'i Bundan tashqari kimyoviy bog'larning yana bir qancha turlari mavjud (metall, bir elektronli, ikki elektronli uch markazli). , lekin ular organik birikmalarda deyarli uchramaydi. 20
Organik birikmalardagi bog'lanish turlari Organik birikmalarning eng xarakterlisi kovalent bog'lanishdir. Kovalent bog'lanish atomlarning o'zaro ta'siri bo'lib, u umumiy elektron juftligini hosil qilish orqali amalga oshiriladi. Ushbu turdagi bog'lanish elektromanfiylik qiymatlari o'xshash bo'lgan atomlar o'rtasida hosil bo'ladi. Elektromanfiylik - boshqa atomlardan elektronlarni o'ziga jalb qilish qobiliyatini ko'rsatadigan atomning xususiyati. Kovalent bog'lanish qutbli yoki qutbsiz bo'lishi mumkin. Elektromanfiylik qiymati bir xil bo'lgan atomlar o'rtasida qutbsiz kovalent bog'lanish paydo bo'ladi
Organik birikmalardagi bog lanish turlari Elektromanfiylik qiymatlari har xil bo lgan atomlar o rtasida qutbli kovalent bog lanish hosil bo ladi. Bunda bog'langan atomlar qisman zaryad oladi d+d+ d-d- Kovalent bog'lanishning maxsus kichik turi donor-akseptor bog'idir. Oldingi misollarda bo'lgani kabi, bu turdagi o'zaro ta'sir umumiy elektron juftligi mavjudligi bilan bog'liq, lekin ikkinchisi bog'ni tashkil etuvchi (donor) atomlardan biri tomonidan ta'minlanadi va boshqa atom (akseptor) tomonidan qabul qilinadi 24.
Organik birikmalardagi bog'lanish turlari Elektromanfiylik qiymatlari jihatidan bir-biridan katta farq qiladigan atomlar o'rtasida ion bog'lanish hosil bo'ladi. Bunday holda, kamroq elektronegativ elementdan (ko'pincha metall) elektron ko'proq elektronegativ elementga to'liq o'tadi. Ushbu elektron o'tish kamroq elektron manfiy atomda musbat zaryad va ko'proq elektronegativ atomda manfiy zaryad paydo bo'lishiga olib keladi. Shunday qilib, zaryadlari qarama-qarshi bo'lgan ikkita ion hosil bo'ladi, ular o'rtasida elektrovalent ta'sir mavjud. 25
Organik birikmalardagi bog'lanish turlari Vodorod bog'i - yuqori qutbli bog'langan vodorod atomi va kislorod, ftor, azot, oltingugurt va xlorning elektron juftlari o'rtasidagi elektrostatik o'zaro ta'sir. Ushbu turdagi o'zaro ta'sir ancha zaif o'zaro ta'sirdir. Vodorod bog'lanishi molekulalararo yoki molekulyar bo'lishi mumkin. Molekulalararo vodorod aloqasi (etil spirtining ikki molekulasi o'rtasidagi o'zaro ta'sir) Salitsil aldegididagi molekulyar vodorod aloqasi 26
Organik molekulalardagi kimyoviy bog'lanish Kimyoviy bog'lanishning zamonaviy nazariyasi elektronlar va atom yadrolaridan tashkil topgan tizim sifatida molekulaning kvant mexanik modeliga asoslanadi. Kvant mexanikasi nazariyasining asosiy kontseptsiyasi atom orbitalidir. Atom orbitali - elektronlarni topish ehtimoli maksimal bo'lgan fazoning bir qismi. Shunday qilib, bog'lanishni har biri qarama-qarshi spinli bitta elektronni olib yuradigan orbitallarning o'zaro ta'siri ("qoplash") sifatida ko'rish mumkin. 27
Atom orbitallarining gibridlanishi Kvant mexanik nazariyasiga ko'ra, atom hosil qilgan kovalent bog'lanishlar soni bir elektronli atom orbitallari soni (juftlanmagan elektronlar soni) bilan belgilanadi. O'zining asosiy holatidagi uglerod atomi faqat ikkita juftlashtirilmagan elektronga ega, ammo elektronning 2s dan 2 pz ga o'tishi to'rtta kovalent bog'lanishni hosil qilish imkonini beradi. Uglerod atomining to'rtta juftlanmagan elektronga ega bo'lgan holati "hayajonlangan" deb ataladi. Uglerod orbitallari teng emasligiga qaramay, atom orbitallarining gibridlanishi tufayli to'rtta ekvivalent bog'lanish hosil bo'lishi mumkinligi ma'lum. Gibridlanish - bu turli shakldagi va energiya jihatidan o'xshash bir nechta orbitallardan bir xil shakl va sondagi bir xil miqdordagi orbitallarning hosil bo'lishi hodisasidir. 28
Organik molekulalardagi uglerod atomining gibrid holatlari BIRINCHI GIBRID HOLA S atomi sp 3 gibridlanish holatida bo`lib, to`rtta s bog` hosil qiladi, to`rtta gibrid orbital hosil qiladi, ular tetraedr (bog`lanish burchagi) s bog` 31 shaklida joylashadi.
Organik molekulalardagi uglerod atomining gibrid holatlari IKKINCHI GIBRID HOVLAT C atomi sp 2 gibridlanish holatida bo'lib, uchta s-bog' hosil qiladi, uchta gibrid orbital hosil qiladi, ular tekis uchburchak shaklida joylashgan (bog'lanish burchagi 120). s-bog'lar p-bog' 32
Organik molekulalardagi uglerod atomining gibrid holatlari UCHINCHI GIBRID HOLA S atomi sp-gibridlanish holatida bo'lib, ikkita s-bog' hosil qiladi, ikkita gibrid orbital hosil qiladi, ular bir chiziqda joylashgan (bog'lanish burchagi 180) s-bog'lar p. - obligatsiyalar 33
Kimyoviy bog'lanishlarning xarakteristikalari POLING shkalasi: F-4.0; O – 3,5; Cl - 3,0; N – 3,0; Br - 2,8; S – 2,5; C-2,5; H-2.1. farq 1.7 Kimyoviy bog'lanishlarning xarakteristikalari Bog'larning qutblanishi - tashqi omillar ta'sirida elektron zichligining siljishi. Bog'larning qutblanishi - elektron harakatchanlik darajasi. Atom radiusi ortishi bilan elektronlarning qutblanish qobiliyati ortadi. Shuning uchun Uglerod - galogen bog ning qutblanish qobiliyati quyidagicha ortadi: C-F Elektron effektlar. Molekuladagi atomlarning oʻzaro taʼsiri 39 Zamonaviy nazariy tushunchalarga koʻra, organik molekulalarning reaktivligi kovalent bogʻ hosil qiluvchi elektron bulutlarning siljishi va harakatchanligi bilan oldindan belgilanadi. Organik kimyoda elektronlar siljishining ikki turi ajratiladi: a) -bog` tizimida sodir bo`ladigan elektron siljishlar, b) -bog`lar tizimi orqali uzatiladigan elektron siljishlar. Birinchi holda, induktiv effekt deb ataladigan narsa, ikkinchisida - mezomer effekti sodir bo'ladi. Induktiv effekt - bu aloqalar tizimidagi molekula atomlari orasidagi elektron manfiylik farqi natijasida yuzaga keladigan elektron zichligi (polyarizatsiya) ning qayta taqsimlanishi. -bog'larning arzimas qutblanishi tufayli induktiv effekt tezda yo'qoladi va 3-4 bog'lanishdan keyin deyarli ko'rinmaydi.
Elektron effektlar. Molekuladagi atomlarning oʻzaro taʼsiri 40 Induktiv effekt tushunchasini K.Ingold kiritgan va u quyidagi belgilarni ham kiritgan: –I-taʼsir oʻrinbosar bilan elektron zichligi kamayishida +I-taʼsir. o'rinbosar tomonidan elektron zichligi ortishi holati ijobiy induktiv ta'sir alkil radikallar tomonidan namoyon bo'ladi (CH 3, C 2 H 5 - va boshqalar). Uglerod atomiga bog'langan barcha boshqa o'rinbosarlar salbiy induktiv ta'sir ko'rsatadi.
Elektron effektlar. Molekuladagi atomlarning o'zaro ta'siri 41 Mezomer effekt - konjugatsiyalangan tizim bo'ylab elektron zichligini qayta taqsimlash. Konjugatsiyalangan tizimlarga organik birikmalar molekulalari kiradi, ularda qo'sh va bitta bog'lar almashinadi yoki p-orbitalda bir juft elektronga ega bo'lgan atom qo'sh bog' yonida joylashganda. Birinchi holda, - kelishik, ikkinchi holatda, p, - kelishik sodir bo'ladi. Birlashtirilgan tizimlar ochiq va yopiq elektron konfiguratsiyalarda keladi. Bunday birikmalarga 1,3-butadien va benzin misol bo'la oladi. Bu birikmalarning molekulalarida uglerod atomlari sp 2 gibridlanish holatida bo`lib, gibrid bo`lmagan p-orbitallar tufayli o`zaro bir-birining ustiga chiqadigan va yagona elektron bulutini hosil qiluvchi -bog`lar hosil qiladi, ya'ni konjugatsiya sodir bo`ladi.
Elektron effektlar. Molekuladagi atomlarning o'zaro ta'siri 42 Mezomerik effektning ikki turi mavjud - musbat mezomer effekt (+M) va salbiy mezomer effekt (-M). Ijobiy mezomer effekt konjugatsiyalangan tizimga p-elektronlarni ta'minlovchi o'rinbosarlar tomonidan namoyon bo'ladi. Bularga quyidagilar kiradi: -O, -S -NH 2, -OH, -OR, Hal (galogenlar) va manfiy zaryadli yoki yolg'iz elektron juftiga ega bo'lgan boshqa o'rinbosarlar. Salbiy mezomer effekt konjugatsiyalangan tizimdan elektron zichligini o'zlashtiradigan o'rinbosarlarga xosdir. Bularga turli elektron manfiylikka ega bo'lgan atomlar o'rtasida bir nechta bog'lanishga ega bo'lgan o'rinbosarlar kiradi: - N0 2; -SO 3H; >C=O; -COON va boshqalar. Mezomerik effekt egilgan strelka orqali grafik tarzda aks ettiriladi, u elektronning siljish yoʻnalishini koʻrsatadi.Induksion effektdan farqli oʻlaroq, mezomer effekt oʻchmaydi. U interfeys zanjirining uzunligidan qat'i nazar, butun tizim bo'ylab to'liq uzatiladi. C=O; -COON va boshqalar. Mezomerik effekt egilgan strelka orqali grafik tarzda aks ettiriladi, u elektronning siljish yoʻnalishini koʻrsatadi.Induksion effektdan farqli oʻlaroq, mezomer effekt oʻchmaydi. Interfeys zanjirining uzunligidan qat'iy nazar, u butun tizim bo'ylab to'liq uzatiladi."> Kimyoviy reaksiyalar turlari 43 Kimyoviy reaksiyani reaktiv va substratning o'zaro ta'siri deb hisoblash mumkin. Molekulalarda kimyoviy bog‘lanishning uzilishi va hosil bo‘lish usuliga ko‘ra organik reaksiyalar quyidagilarga bo‘linadi: a) gomolitik b) geterolitik c) molekulyar Gomolitik yoki erkin radikal reaksiyalar bog‘ning gomolitik ajralishi natijasida, har bir atomda bittadan elektron qolganda sodir bo‘ladi. , ya'ni radikallar hosil bo'ladi. Gomolitik parchalanish yuqori haroratda, yorug'lik kvantining ta'sirida yoki katalizda sodir bo'ladi.
Geterolitik yoki ionli reaksiyalar shunday boradiki, bir juft bogʻlovchi elektronlar atomlardan birining yonida qoladi va ionlar hosil boʻladi. Elektron juftiga ega bo'lgan zarracha nukleofil deb ataladi va manfiy zaryadga (-) ega. Elektron jufti bo'lmagan zarracha elektrofil deb ataladi va musbat zaryadga ega (+). 44 Kimyoviy reaksiyalarning turlari
Kimyoviy reaksiya mexanizmi 45 Reaksiya mexanizmi deganda berilgan reaksiyani tashkil etuvchi elementar (oddiy) bosqichlar yig`indisi tushuniladi. Reaktsiya mexanizmi ko'pincha quyidagi bosqichlarni o'z ichiga oladi: elektrofil, nukleofil yoki erkin radikal hosil bo'lishi bilan reagentning faollashishi. Reaktivni faollashtirish uchun odatda katalizator kerak bo'ladi. Ikkinchi bosqichda faollashtirilgan reagent substrat bilan o'zaro ta'sir qiladi. Bunda oraliq zarrachalar (oraliq moddalar) hosil bo'ladi. Ikkinchisiga -komplekslar, -komplekslar (karbokationlar), karbanionlar va yangi erkin radikallar kiradi. Yakuniy bosqichda ikkinchi bosqichda hosil bo'lgan oraliq mahsulotga (dan) zarrachaning qo'shilishi yoki yo'q qilinishi yakuniy reaktsiya mahsulotining shakllanishi bilan sodir bo'ladi. Agar reagent faollashganda nukleofil hosil qilsa, bu nukleofil reaktsiyalardir. Ular N harfi bilan belgilanadi - (indeksda). Agar reagent elektrofil hosil qilsa, reaksiyalar elektrofil (E) deb tasniflanadi. Xuddi shu narsani erkin radikal reaktsiyalar (R) haqida ham aytish mumkin.
Nukleofillar manfiy zaryadli yoki elektron zichligi boyitilgan atomga ega boʻlgan reaktivlardir: 1) anionlar: OH -, CN -, RO -, RS -, Hal - va boshqa anionlar; 2) yakka juft elektronli neytral molekulalar: NH 3, NH 2 R, H 2 O, ROH va boshqalar; 3) ortiqcha elektron zichligi bo'lgan molekulalar (bo'lgan - bog'lar). Elektrofillar musbat zaryadga yoki elektron zichligi kamaygan atomga ega bo'lgan reaktivlardir: 1) kationlar: H + (proton), HSO 3 + (vodorod sulfoniy ioni), NO 2 + (nitroniy ioni), NO (nitrosoniy ioni) va boshqalar. kationlar; 2) bo'sh orbitali bo'lgan neytral molekulalar: AlCl 3, FeBr 3, SnCl 4, BF 4 (Lyuis kislotalari), SO 3; 3) atomdagi elektron zichligi kamaygan molekulalar. 46
49
50
51
52
Salom! Ko'pgina tibbiyot talabalari biokimyo deb ham ataladigan bioorganik kimyoni o'rganishmoqda. Ba'zi universitetlarda bu fan test bilan, boshqalarida esa imtihon bilan tugaydi. Ba'zida shunday bo'ladiki, bitta universitetdagi test boshqa universitetdagi imtihon bilan solishtirish mumkin. Mening universitetimda bioorganik kimyo birinchi kurs oxirida yozgi sessiyada imtihon sifatida qabul qilindi. Aytish kerakki, BOC birinchi navbatda dahshatli bo'lgan va "buni o'tkazib yuborish mumkin emas" degan fikrni ilhomlantiradigan mavzulardan biridir. Bu, ayniqsa, organik kimyo bo'yicha zaif asosga ega bo'lgan odamlar uchun to'g'ri keladi (va, g'alati, tibbiyot universitetlarida ularning bir nechtasi bor). Turli universitetlarda bioorganik kimyoni o'rganish dasturlari juda xilma-xil bo'lishi mumkin va o'qitish usullari bundan ham farq qilishi mumkin. Biroq, talabalar uchun talablar hamma joyda taxminan bir xil. Oddiy qilib aytganda, bioorganik kimyodan 5 ball bilan o'tish uchun siz bir qator organik moddalarning nomlarini, xususiyatlarini, tuzilish xususiyatlarini va tipik reaktsiyalarini bilishingiz kerak. O‘qituvchimiz, hurmatli professor materialni go‘yo har bir talaba maktabdagi organik kimyo bo‘yicha eng yaxshi talabadek taqdim etdi (bioorganik kimyo esa maktab organik kimyosining murakkab kursidir). Ehtimol, u o'z yondashuvida to'g'ri bo'lgan, har bir kishi eng yuqori cho'qqiga chiqishga intilishi va eng yaxshi bo'lishga harakat qilishi kerak. Biroq, bu dastlabki 2-3 sinfda materialni qisman tushunmagan ba'zi talabalar semestr o'rtalariga yaqin hamma narsani tushunishni to'xtatib qo'yishiga olib keldi. Men ushbu materialni yozishga qaror qildim, chunki men shunchaki talaba edim. Maktabda men noorganik kimyoni juda yaxshi ko'rardim, lekin men doimo organik moddalar bilan kurashardim. Yagona davlat imtihoniga tayyorgarlik ko'rayotganimda ham, men noorganika bo'yicha barcha bilimlarimni mustahkamlash strategiyasini tanladim va shu bilan birga faqat organik moddalar bazasini birlashtirdim. Aytgancha, bu kirish nuqtalari nuqtai nazaridan menga deyarli teskari ta'sir ko'rsatdi, ammo bu boshqa voqea. O'qitish metodikasi haqida bejiz aytganim yo'q, chunki bizniki ham g'ayrioddiy edi. Darhol, deyarli birinchi sinfda bizga qo'llanmalar ko'rsatildi, unga ko'ra biz testlarni, keyin esa imtihonni topshirishimiz kerak edi. Bizning butun kursimiz 4 ta asosiy mavzuga bo'lingan bo'lib, ularning har biri test darsi bilan yakunlandi. Birinchi juftlikdagi to'rtta testning har biri uchun bizda allaqachon savollar bor edi. Ular, albatta, qo'rqinchli edi, lekin ayni paytda ular harakatlanish uchun o'ziga xos xarita bo'lib xizmat qildilar. Birinchi sinov juda oddiy edi. U asosan nomenklaturaga, ahamiyatsiz (kundalik) va xalqaro nomlarga va, albatta, moddalar tasnifiga bag'ishlangan edi. Bundan tashqari, u yoki bu shaklda aromatiklik belgilariga tegildi. Birinchisidan keyingi ikkinchi sinov ancha qiyinroq tuyuldi. U erda ketonlar, aldegidlar, spirtlar, karboksilik kislotalar kabi moddalarning xossalari va reaktsiyalarini tasvirlash kerak edi. Masalan, aldegidlarning eng tipik reaksiyalaridan biri kumush oyna reaksiyasidir. Juda chiroyli manzara. Agar biron-bir aldegidga Tollens reaktivi, ya'ni OH qo'shsangiz, probirka devorida oynaga o'xshash cho'kmani ko'rasiz, u shunday ko'rinadi: Uchinchi sinov ikkinchisiga nisbatan unchalik dahshatli ko'rinmadi. Har bir inson allaqachon reaktsiyalarni yozishga va tasniflarga ko'ra xususiyatlarni eslab qolishga odatlangan. Uchinchi testda biz ikkita funktsional guruhga ega bo'lgan birikmalar - aminofenollar, aminokislotalar, okso kislotalar va boshqalar haqida gapirdik. Bundan tashqari, har bir chiptada uglevodlar haqida kamida bitta chipta mavjud edi. Bioorganik kimyo bo'yicha to'rtinchi sinov deyarli butunlay oqsillar, aminokislotalar va peptid aloqalariga bag'ishlandi. RNK va DNKni to'plashni talab qiladigan savollar alohida e'tiborga loyiq edi. Aytgancha, aminokislota aynan shunday ko'rinadi - siz aminokislotalarni (bu rasmda sariq rangga bo'yalgan) va karboksilik kislota guruhini (bu lilak) ko'rishingiz mumkin. To'rtinchi sinovda biz ushbu toifadagi moddalar bilan shug'ullanishimiz kerak edi. Har bir test taxtada o'tkazildi - talaba barcha kerakli xususiyatlarni reaktsiyalar shaklida tushuntirishi va tushuntirishi kerak. Misol uchun, agar siz ikkinchi testdan o'tayotgan bo'lsangiz, chiptangizda spirtli ichimliklarning xususiyatlari mavjud. O'qituvchi sizga aytadi - propanolni oling. Propanol formulasini va uning xususiyatlarini ko'rsatish uchun 4-5 tipik reaktsiyani yozing. Oltingugurt o'z ichiga olgan birikmalar kabi ekzotik narsalar ham bo'lishi mumkin. Hatto bitta reaksiya mahsuloti indeksidagi xatolik meni ko'pincha keyingi urinishgacha (bir haftadan keyin) ushbu materialni o'rganishga majbur qildi. Qo'rqinchlimi? Qattiqmi? Albatta! Biroq, bu yondashuv juda yoqimli yon ta'sirga ega. Muntazam seminar mashg'ulotlarida qiyin bo'ldi. Ko'pchilik testlarni 5-6 marta topshirdi. Ammo imtihon juda oson kechdi, chunki har bir chiptada 4 ta savol bor edi. Aynan o'rganilgan va hal qilingan har bir testdan bittadan. Shuning uchun, men bioorganik kimyo bo'yicha imtihonga tayyorgarlik ko'rishning nozik tomonlarini tasvirlamayman. Bizning holatlarimizda, barcha tayyorgarlik testlarga qanday tayyorgarlik ko'rganimizga bog'liq edi. Men to'rtta testning har biridan ishonchli tarzda o'tdim - imtihondan oldin o'zingizning qoralamalaringizni ko'rib chiqing, eng oddiy reaktsiyalarni yozing va hamma narsa darhol tiklanadi. Gap shundaki, organik kimyo juda mantiqiy fan. Esda tutishingiz kerak bo'lgan narsa - bu reaktsiyalarning katta qatorlari emas, balki mexanizmlarning o'zi. Ha, shuni ta'kidlaymanki, bu barcha elementlar bilan ishlamaydi. Bir kun oldin eslatmalaringizni o'qib, dahshatli anatomiyadan o'ta olmaysiz. Bir qator boshqa narsalar ham o'ziga xos xususiyatlarga ega. Tibbiyot maktabingiz bioorganik kimyoni boshqacha o'rgatgan bo'lsa ham, siz tayyorgarlikni sozlashingiz va buni mendan biroz boshqacha qilishingiz kerak bo'lishi mumkin. Nima bo'lganda ham sizga omad, ilmni tushuning va seving!



























































































Bioorganik kimyo - testlar va imtihonlar