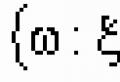Спирты: физические и химические свойства, получение, применение. Спирты — понятие, свойства, применение Спирты примеры
Спирты - сложные органические соединения, углеводороды, обязательно содержащие один или несколько гидроксилов (групп ОН-), связанных с углеводородным радикалом.
История открытия
По мнению историков, уже за 8 веков до нашей эры человек употреблял напитки, содержащие этиловый спирт. Их получали методом сбраживания фруктов или меда. В чистом виде этанол был выделен из вина арабами примерно в VI-VII веках, а европейцами - на пять столетий позже. В XVII веке перегонкой древесины был получен метанол, а в XIX веке химики установили, что спирты - это целая категория органических веществ.
Классификация
По количеству гидроксилов спирты делят на одно-, двух-, трех-, многоатомные. Например, одноатомный этанол; трехатомный глицерин.
- По тому, с каким числом радикалов связан атом углерода, соединенный с группой ОН-, спирты разделяют на первичные, вторичные, третичные.
- По характеру связей радикала спирты бывают предельными, непредельными, ароматическими. В ароматических спиртах гидроксил связан не напрямую с бензольным кольцом, а через другой (другие) радикалы.
- Соединения, в которых ОН- прямо связана с бензольным циклом, считаются отдельным классом фенолов.
Свойства
 В зависимости от того, сколько в молекуле углеводородных радикалов, спирты могут быть жидкими, вязкими, твердыми. Водорастворимость уменьшается с ростом количества радикалов.
В зависимости от того, сколько в молекуле углеводородных радикалов, спирты могут быть жидкими, вязкими, твердыми. Водорастворимость уменьшается с ростом количества радикалов.
Простейшие спирты смешиваются с водой в любых пропорциях. Если же в молекулу входит более 9 радикалов, то вообще не растворяются в воде. Все спирты хорошо растворяются в органических растворителях.
- Спирты горят, выделяя большое количество энергии.
- Вступают в реакции с металлами, в результате чего получаются соли - алкоголяты.
- Взаимодействуют с основаниями, проявляя качества слабых кислот.
- Реагируют с кислотами и ангидридами, проявляя оснóвные свойства. Результатом реакций являются сложные эфиры.
- Воздействие сильными окислителями приводит к образованию альдегидов или кетонов (в зависимости от вида спирта).
- При определенных условиях из спиртов получают простые эфиры, алкены (соединения с двойной связью), галогенуглеводороды, амины (производные от аммиака углеводороды).
Спирты токсичны для человеческого организма, некоторые - ядовиты (метилен, этиленгликоль). Этилен оказывает наркотическое воздействие. Опасны и пары спиртов, поэтому работы с растворителями на основе спирта должны производиться с соблюдением техники безопасности.
Тем не менее, спирты участвуют в естественном метаболизме растений, животных и человека. К категории спиртов относятся такие жизненно важные вещества как витамины A и D, стероидные гормоны эстрадиол и кортизол. Более половины липидов, поставляющих энергию нашему организму, имеют в своей основе глицерин.
Применение
В органическом синтезе.
- Биотопливо, добавки в топливо, ингредиент тормозной жидкости, гидравлических жидкостей.
- Растворители.
- Сырье для производства ПАВ, полимеров, пестицидов, антифризов, взрывчатых и отравляющих веществ, бытовой химии.
- Душистые вещества для парфюмерии. Входят в состав косметических и медицинских средств.
- Основа алкогольных напитков, растворитель для эссенций; сахарозаменитель (маннит и т.п.); краситель (лютеин), ароматизатор (ментол).
В нашем магазине можно купить спирты разного вида.
Бутиловый спирт
Одноатомный спирт. Применяется в качестве растворителя; пластификатора при  изготовлении полимеров; модификатора формальдегидных смол; сырья для органического синтеза и получения душистых веществ для парфюмерии; добавки к топливу.
изготовлении полимеров; модификатора формальдегидных смол; сырья для органического синтеза и получения душистых веществ для парфюмерии; добавки к топливу.
Фурфуриловый спирт
Одноатомный спирт. Востребован для полимеризации смол и пластиков, как растворитель и пленкообразователь в лакокрасочной продукции; сырье для органического синтеза; связующий и уплотняющий агент при производстве полимербетона.
Изопропиловый спирт (пропанол-2)
Вторичный одноатомный спирт. Активно используется в медицине, металлургии, химпроме. Заменитель этанола в парфюмерных, косметических, дезинфицирующих продуктах, средствах бытовой химии, антифризах, очистителях.
Этиленгликоль
Двухатомный спирт. Применяется при производстве полимеров; красок для типографий и текстильного производства; входит в состав антифризов, тормозных жидкостей, теплоносителей. Используется для осушения газов; как сырье для органического синтеза; растворитель; средство для криогенной «заморозки» живых организмов.
Глицерин
Трехатомный спирт. Востребован в косметологии, пищепроме, медицине, как сырье в орг. синтезе; для изготовления взрывчатого вещества нитроглицерина. Применяется в сельском хозяйстве, электротехнике, текстильной, бумажной, кожевенной, табачной, лакокрасочной индустрии, в производстве пластиков и средств бытовой химии.
Маннит
Шестиатомный (многоатомный) спирт. Применяется как пищевая добавка; сырье для изготовления лаков, красок, олиф, смол; входит в состав ПАВ, парфюмерных продуктов.
Спирты.
Спирты – это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами (ОН).
Так метиловый спирт СН 3 -ОН представляет собой гидроксильное производное метана СН 4 , этиловый спирт С 2 Н 5 -ОН – производное этана .
Название спиртов образуется добавлением окончания «-ол » к названию соответствующего углеводорода (метанол, этанол и т.д)
Производные ароматических углеводородов с группой ОН в бензольном ядре называются фенолами .

Свойства спиртов.
Подобно молекулам воды, молекулы низших спиртов связываются между собой водородными связями. По этой причине температура кипения спиртов выше, чем температура кипения соответствующих углеводородов.
Общим свойством спиртов и фенолов является подвижность водорода гидроксильной группы. При действии на спирт щелочного метала этот водород вытесняется металом и получаются твёрдые, растворимые в спирте соединения, называемые алкоголятами .
Спирты взаимодействуют с кислотами, образуя сложные эфиры .
Спирты значительно легче окисляются, чем соответствующие углеводороды. При этом образуются альдегиды и кетоны .
Спирты практически не являются электролитами, т.е. не прводят электрический ток.
Метиловый спирт.
Метиловый спирт (метанол) СН 3 ОН – бесцветная жидкость. Весьма ядовит: приём небольших его доз вутрь вызывает слепоту, а больших – смерть.
Метиловый спирт получают в больших количествах синтезом из окиси углерода и водорода при высоком давлении (200-300 атм. ) и высокой температуре (400 град С ) в присутствии катализатора.
Метиловый спирт образуется при сухой перегонке дерева; поэтому его также называют древесным спиртом.
Он применяется как растворитель, а также для получения других органических веществ.
Этиловый спирт.
Этиловый спирт (этанол) С 2 Н 5 ОН – одно из важнейших исходных веществ в современной промышленности органического синтеза.
Для получения его издавна пользуются различными сахаристыми веществами, которые путём брожения превращаются в этиловый спирт. Брожение вызывается действием ферментов (энзимов), вырабатываемых дрожжевыми грибками.
В качестве сахаристых веществ используют виноградный сахар или глюкозу:

Глюкоза в свободном виде содержится, например, в виноградном соке , при брожении которого получается виноградное вино с содержанием спирта от 8 до 16%.
Исходным продуктом для получения спирта может служить полисахарид крахмалл , cодержащийся, например в клубнях картофеля , зерна ржи , пшеницы, кукурузы . Для превращения в сахаристые вещества (глюкозу) крахмал предварительно подвергают гидролизу.
В настоящее время осахариванию подвергается также другой полисахарид – целюлозу (клетчатку), образующую главную массу древесины . Целюлозу (например, древесные опилки ) также предварительно подвергают гидролизу в присутствии кислот. Полученный таким образом продукт также содержит глюкозу и сбраживается на спирт при помощи дрожжей.
Наконец, этиловый спирт может быть получен синтетическим путём из этилена . Суммарная реакция заключается в присоединении воды к этилену.
Реакция протекает в присутствии катализаторов.
Многоатомные спирты.
До сих пор мы рассматривали спирты с одной гидроксильной группой (ОН ). Такие спирты называются алкоголями.
Но также известны спирты, молекулы которых содержат несколько гидроксильных групп. Такие спирты называются многоатомными.
Примерами таких спиртов могут служить двухатомный спирт этиленгликоль и трёхатомный спирт глицерин:

Этиленгликоль и глицерин – жидкости сладковатого вкуса, смешивающиеся с водой в любых соотношениях.
Использование многоатомных спиртов.
Этиленгликоль применяется в качестве составной части, так называемых антифризов , т.е. веществ с низкой температурой замерзания, заменяющих воду в радиаторах автомобильных и авиационных моторов в зимнее время.
Также, этиленгликоль используют в производстве целлофана, полиуретанов и ряда других полимеров, как растворитель красящих веществ, в органическом синтезе.
Область применения глицерина разнообразна: пищевая промышленность, табачное производство, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника.
Глицерин относится к группе стабилизаторов . При этом, он обладает свойствами сохранять и увеличивать степень вязкости различных продуктов, и таким образом менять их консистенцию. Зарегистрирован как пищевая добавка Е422 , и используется в качестве эмульгатора , при помощи которого смешиваются различные несмешиваемые смеси.
Спирты – разнообразный и обширный класс химических соединений.
Спирты – это химические соединения, молекулы которых содержатся гидроксильные группы ОН, соединённые с углеводородным радикалом.
Углеводородный радикал состоит из атомов углерода и водорода. Примеры углеводородных радикалов - СН 3 - метил, С 2 Н 5 – этил. Часто углеводородный радикал обозначают просто буквой R. Но если в формуле присутствуют разные радикалы, их обозначают R", R ", R """ и т.д.
Названия спиртов образуются путём добавления суффикса –ол к названию соответствующего углеводорода.
Классификация спиртов

Спирты бывают одноатомные и многоатомные. Если в молекуле спирта только одна гидроксильная группа, то такой спирт называется одноатомным. Если же количество гидроксильных групп 2, 3, 4 и т.д., то это многоатомный спирт.
Примеры одноатомных спиртов: СН 3 -ОН – метанол или метиловый спирт, СН 3 СН 2 -ОН – этанол или этиловый спирт.
Соответственно, в молекуле двухатомного спирта присутствуют две гидроксильные группы, в молекуле трёхатомного – три и т.д.
Одноатомные спирты
Общую формулу одноатомных спиртов можно представить как R-OH.
По типу свободного радикала, входящего в молекулу, одноатомные спирты делятся на предельные (насыщенные), непредельные (ненасыщенные) и ароматические спирты.
В насыщенных углеводородных радикалах атомы углерода соединены простыми связями С – С. В ненасыщенных радикалах присутствуют одна или несколько пар атомов углерода, соединённых двойными С = С или тройными С ≡ С связями.
В состав предельных спиртов входят предельные радикалы.
CH 3 CH 2 CH 2 -OH – предельный спирт пропанол-1 или пропиленовый спирт.
Соответственно, непредельные спирты содержат непредельные радикалы.
CH 2 = CH - CH 2 - OH – непредельный спирт пропенол 2-1 (аллиловый спирт)
А в молекулу ароматических спиртов входит бензольное кольцо C 6 H 5.
C 6 H 5 -CH 2 -OH – ароматический спирт фенилметанол (бензиловый спирт).
В зависимости от типа атома углерода, связанного с гидроксильной группой, спирты делятся на первичные ((R-CH 2 -OH), вторичные (R-CHOH-R") и третичные (RR"R""C-OH) спирты.
Химические свойства одноатомных спиртов

1. Спирты горят, образуя углекислый газ и воду. При горении выделяется тепло.
C 2 H 5 OH + 3O 2 → 2CO 2 + 3H 2 O
2. При реакции спиртов со щелочными металлами образуется алкоголят натрия и выделяется водород.
C 2 H 5 -OH + 2Na → 2C 2 H 5 ONa + H 2
3. Реакция с галогеноводородом. В результате реакции образуется галогеноалкан (бромэтан и вода).
C 2 H 5 OH + HBr → C 2 H 5 Br + H 2 O
4. Внутримолекулярная дегидратация происходит при нагревании и под воздействием концентрированной серной кислоты. В результате получается непредельный углеводород и вода.
Н 3 – СН 2 – ОН → СН 2 = СН 2 + Н 2 О
5. Окисление спиртов. При обычной температуре спирты не окисляются. Но при помощи катализаторов и при нагревании окисление происходит.
Многоатомные спирты
Как вещества, содержащие гидроксильные группы, многоатомные спирты имеют химические свойства, схожие со свойствами одноатомных спиртов, но реакция у них идёт сразу по нескольким гидроксильным группам.
Многоатомные спирты вступают в реакцию с активными металлами, с галогеноводородными кислотами, с азотной кислотой.
Получение спиртов

Рассмотрим способы получения спиртов на примере этанола, формула которого С 2 Н 5 ОН.
Наиболее старый из них – отгонка спирта из вина, где он образуется в результате брожения сахаристых веществ. Сырьём для получения этилового спирта служат также крахмалосодержащие продукты, которые с помощью процесса брожения превращают в сахар, который затем сбраживают в спирт. Но производство этилового спирта таким способом требует большого расхода пищевого сырья.
Гораздо совершеннее синтетический способ получения этилового спирта. В этом случае проводят гидратацию этилена водяным паром.
С 2 Н 4 + Н 2 О → С 2 Н 5 ОН
Среди многоатомных спиртов наиболее известен глицерин, который получают расщеплением жиров или синтетическим способом из пропилена, который образуется при высокотемпературной переработке нефти.
1. Классификация гидроксилпроизводных углеводородов.
2. Предельные одноатомные спирты (алканолы).
3. Многоатомные спирты.
4. Фенолы.
5. Простые эфиры.
Гидроксилпроизводными углеводородов называются соединения, которые образуются в результате замещения в молекуле углеводорода одного или нескольких атомов водорода на гидроксильные группы.
Гидроксилпроизводные углеводородов со связью С(sр 3)-ОН называются спиртами. Это предельные алифатические и циклические спирты, например СН 3 ОН и,
непредельные спирты, например СН 2 =СН-СН 2 -ОН, ароматические спирты -
Гидроксилпроизводные, содержащие связь С(sр 2)-ОН, называются енолами R-СН=СН-ОН и фенолами
По числу гидроксильных групп, содержащихся в молекуле, спирты и фенолы могут быть одно (одна ОН-группа)-, двух (две ОН-группы)-, трех- и многоатомными.
Нахождение в природе. В отличие от галогенопроизводных углеводородов спирты и фенолы, их производные широко представлены в растительном и животном мире.
Высшие спирты встречаются в свободном виде (например, цетиловый спирт С 16 Н 33 ОН), в составе сложных эфиров с высшими жирными кислотами (спермацет, воски). Непредельные спирты являются составной частью эфирных масел. Природными циклическими спиртами являются ментол и холестерин. Глицерин входит в состав природных растительных и животных жиров и масел.
Фенолы и их простые эфиры входят в состав эфирных масел многих душистых растений, например чабреца, тимьяна, тмина, аниса, эстрагона, укропа и т.д. Многоатомные фенолы и их производные - душистые вещества растений (например гвоздики, мускатного ореха), составная часть гликозидов растений, дубильных веществ чая, кофе и т.д.
1. Предельные одноатомные спирты (алканолы).
Общая формула С n Н 2 n +1 ОН.
Номенклатура. По заместительной номенклатуре гидроксильная группа в названии спиртов обозначается суффиксом -ол. По радикально-функциональной номенклатуре в названии указывают радикал и добавляют -овый спирт: С 2 Н 5 ОН - этанол или этил овый спирт,
СН 3 -СН 2 -СН 2 -ОН - пропанол-1 или пропил овый спирт.
Получение:
а) гидролиз галогеналканов. Галогеналканы в реакциях с водой или водным раствором щелочи легко образуют спирты (см. «Галогенпроизводные углеводородов»):
С 2 Н 5 Вr + NаОН(водный раствор) → С 2 Н 5 ОН + NаВr.
б) гидратация алкенов. Присоединение воды к алкенам происходит в присутствии катализатора (см. «Алкены»):
СН 2 =СН 2 + Н-ОН СН 3 -СН 2 -ОН.
в) гидрирование карбонильных соединений.
Каталитическое гидрирование альдегидов и кетонов приводит к образованию спиртов (см. «Альдегиды и кетоны»):
СН 3 -СН=О + Н 2 → СН 3 -СН 2 -ОН

Катализаторы: Ni, Pt, Pd.
г) реакции магнийорганических соединений. Легко происходит присоединение магнийорганических соединений к альдегидам и кетонам (см.«Альдегиды и кетоны»):
Из метаналя образуется первичный спирт, из альдегидов - вторичные спирты, кетонов - третичные спирты.
Особенность реакций этого типа - продукты реакции - спирты содержат больше атомов углерода по сравнению с исходными карбонильными соединениями.
д) гидрирование оксида углерода (II). В зависимости от природы катализатора и условий реакции получают метанол или смесь различных спиртов (синтол): СО + 2Н 2 → СН 3 -ОН.
Катализаторы: ZnO, Co и другие.
е) спиртовое брожение углеводов. Глюкоза в присутствии дрожжей подвергается брожению с образованием этилового спирта и углекислого газа: С 6 Н 12 О 6 → 2СН 3 -СН 2 -ОН + 2СО 2
Изомерия. Для предельных спиртов характерна структурная изомерия: изомерия углеродной цепи, расположения гидроксильной группы в цепи. По положению гидроксильной группы в цепи различают первичные (R-СН 2 -ОН), вторичные (R 2 СН-ОН) и третичные (R 3 С-ОН) спирты.
Для спиртов характерна межклассовая изомерия (метамерия), спиртам изомерны простые эфиры с общей формулой R-O-R.
СН 3 -СН 2 -СН ОН-СН 3 (см. «Оптическая изомерия»).
Строение. В спиртах атомы углерода и кислорода находятся вsр 3 - гибридизации. Спирты содержат две полярные σ-связи: С-О (sр 3 -sр 3 -перекрывание) и О-Н (sр 3 -s -перекрывание). Диполи этих связей направлены в сторону атома кислорода, причем дипольный момент связи О-Н выше, чем связи С-О. Алканолы являются полярными соединениями:
Ассоциация молекул спиртов осуществляется за счет образования межмолекулярных водородных связей:

в результате спирты, по сравнению с углеводородами и галогенпроизводными углеводородов, имеют более высокие температуры кипения и плавления. Образование водородных связей между молекулами спиртов и воды способствует растворению этих соединений в воде.
Химические свойства.
Химические свойства спиртов обусловлены наличием в молекуле полярных связей С-О и О-Н и неподеленных электронных пар на атоме кислорода.
а) кислотные свойства
Спирты являются слабыми О-Н-кислотами. Ряд кислотности: RСООН > НОН > RОН.
В водном растворе кислотность самих спиртов уменьшается в следующем направлении: метанол > первичные > вторичные > третичные.
Кислотные свойства спиртов проявляются в образовании солей (алкоголятов или алкоксидов) при взаимодействии с металлами:
2С 2 Н 5 ОН + 2Nа → 2 С 2 Н 5 О - Nа + + Н 2
этанол этилат(этоксид) натрия
В водных растворах соли гидролизуются с образованием спиртов и щелочей:
С 2 Н 5 О - Nа + + НОН → С 2 Н 5 ОН + NаОН
б) основные и нуклеофильные свойства
Основные и нуклеофильные свойства спиртов обусловлены неподеленной электронной парой на атоме кислорода.
Основные свойства увеличиваются в следующем направлении
метанол < первичные < вторичные < третичные спирты и проявляются в образовании оксониевых солей: С 2 Н 5 ОН + Н + → С 2 Н 5 ОН 2 + . Образование оксониевых солей играет важную роль в реакциях нуклеофильного замещения и отщепления.
Таким образом, спирты являются амфотерными соединениями.
Слабые нуклеофильные свойства спиртов и алкоголятов проявляются в реакциях
Алкилирования - взаимодействия со спиртами и алкоголятами с образованием простых эфиров (реакция Вильямсона, протекает при нагревании): СН 3 B r + С 2 Н 5 О Nа → С 2 Н 5 ОСН 3 + NаBr
метилбромид этилат натрия метоксиэтан,
Ацилирования - взаимодействия с карбоновыми кислотами и их производными с образование сложных эфиров (реакция этерификации, протекает в присутствии катализатора):
СН 3 СООН + С 2 Н 5 О Н ↔ СН 3 СООС 2 Н 5 + НОН
уксусная кислота этанол этилацетат,
С карбонильными соединениями - образование полуацеталей и ацеталей:
этаналь метанол 1-метоксиэтанол 1,2-диметоксиэтанол.
Алкоголяты по сравнению со спиртами являются более сильными основаниями и нуклеофилами.
в) реакции замещения гидроксильной группы (нуклеофильное замещение - S N )
Часто в этих реакциях ОН-группу модифицируют с помощью минеральных кислот или кислот Льюиса (образование оксониевых солей RОН 2 +). Модифицированная гидроксильная группа легко замещается на атом галогена, амино- и алкоксигруппу и другие группы. Реакционная активность спиртов в этих реакциях увеличивается в следующем направлении: первичные < вторичные < третичные.
Примеры реакций. Замещение гидроксильной группы на атом галогена:
R-ОН + SOCl 2 → R-Cl + НCl + SО 2
R-ОН + РН al 5 → R-Нal + Н-Нal + РОНal 3
R-ОН + Н-Н al → R-Нal + НОН
Реакционная активность галогеноводородов увеличивается в направлении НСl < НBr <НJ. Однако иодоводород практически не используют в реакциях этого типа, поскольку он легко восстанавливает спирты до углеводородов.
Замещение гидроксильной группы на амино- и алкоксигруппу:
R-ОН + Н- N Н 2 →R- NН 2 + НОН
R-ОН + RО- Н→ R-О-R + НОН.
Взаимодействие с минеральными кислотами с образованием сложных эфиров:
R-ОН + Н-О N О 2 →R-ОNО 2 + НОН
алкилнитрат
R-ОН + Н-О S О 3 →R-ОSО 3 + НОН
алкилсульфат
Реакции нуклеофильного замещения протекают по мономолекулярному (S N 1) или бимолекулярному (S N 2) механизму.
г) реакции отщепления гидроксильной группы (Е-типа, дегидратация спиртов)
Отщепление воды происходит при нагревании в присутствии катализатора - серной или фосфорной кислот, оксида цинка или алюминия. Дегидратация спиртов с образованием алкенов протекает в соответствии с правилом Зайцева: гидроксильная группа отщепляется от α-углеродного атома, водород - от менее гидрированного β-атома углерода спирта:
1-бутанол 2-бутен
Реакционная активность спиртов увеличивается в следующем направлении: первичные < вторичные < третичные.
Реакции отщепления протекают по мономолекулярному (Е1) или бимолекулярному (Е2) механизму.
д) окисление спиртов
В реакциях окисления более активны первичные спирты, третичные спирты в аналогичных условиях не окисляются. Окислители: перманганат калия или бихромат калия в кислой среде. Первичные спирты окисляются с образованием альдегидов и далее - карбоновых кислот, вторичные спирты - кетонов:
R-ОН + [ О ] → R-СН=О → R-СООН
R 2 СН-ОН + [ О ] → R 2 С=О
Первичные и вторичные спирты могут быть превращены в карбонильные соединения при дегидрировании. Реакции протекают при 400-500 0 С в присутствии катализатора - Cu/Аg:

Это производные углеводородов, в которых один атом водорода замещен на гидрокси- группу. Общая формула спиртов - CnH 2 n +1 OH .
Классификация одноатомных спиртов.
В зависимости от положения, где расположена ОН -группа, различают:
Первичные спирты:
Вторичные спирты:

Третичные спирты:
 .
.
Изомерия одноатомных спиртов.
Для одноатомных спиртов характерна изомерия углеродного скелета и изомерия положения гидрокси-группы.
Физические свойства одноатомных спиртов.
Реакция идет по правилу Марковникова, поэтому из первичных алкенов можно получить только певичный спирт.
2. Гидролиз алкилгалогенидов при воздействии водных растворов щелочей:
Если нагрев слабый, то происходит внутримолекулярная дегидратация, в результате чего образуются простые эфиры:
Б) Спирты могут реагировать с галогенводородами, причем третичные спирты реагируют очень быстро, а первичные и вторичные - медленно:

Применение одноатомных спиртов.
Спирты используют преимущественно в промышленном органическом синтезе, в пищевой промышленности, в медицине и фармации.