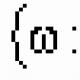Неорганическая химия. Презентация к уроку Сероводород
Цель урока: Закрепить знания учащихся по пройденной теме: аллотропия серы, физические и химические свойства, применение серы, нахождение в природе. Рассмотреть свойства соединения серы - сероводорода и её солей. Рассмотреть влияние сероводорода на окружающую среду и здоровье человека. Рассмотреть влияние сероводорода на окружающую среду и здоровье человека. уметь составлять уравнения реакций в молекулярном виде и с точки зрения окислительно - восстановительных процессов Нравственное и эстетическое воспитание учащихся к окружающей среде.
"Тогда услышал я (о, диво!), запах скверный, Как будто тухлое разбилося яйцо, Или карантинный страж курил жаровней серной. Я, нос себе зажав, отворотил лицо..." Пушкин А.С.

СвойстваСероводород Химическая формула вещества Тип химической связи Агрегатное состояние при н.у. Цвет Плотность по воздуху Запах Нахождение в природе Растворимость в воде (уравнение диссоциации) Получение в лаборатории (уравнение реакции Окислительно-восстановительные свойства Кислотно-основные свойства Качественная реакция на сульфид –ионы Физиологическое действие Загрязнение окружающей среды Применение

Молекулярная формула Н 2 S степень окисления серы (-2). Ковалентная полярная связь Молекула сероводорода имеет угловую форму, поэтому она полярна. В отличие от молекул воды, атомы водорода в молекуле не образуют прочных водородных связей, поэтому сероводород является газом.


В свободном состоянии встречается в составе вулканических газов, во многих источниках вулканических местностей, входит в состав вулканического пепла в растворенном и отчасти в свободном состоянии сероводород содержится в Черном море, начиная с глубины 200 и более метров. в растворенном и отчасти в свободном состоянии сероводород содержится в Черном море, начиная с глубины 200 и более метров. в небольших количествах он образуется всюду, где происходит разложение или гниение органических веществ: она присутствует в минеральных грязях, образующихся на дне неглубоких соляных озер; в виде смешанных веществ нефти и газа. для некоторых микроорганизмов (серобактерии) сероводород не яд, а питательное вещество. Усваивая сероводород они выделяют свободную серу. Такие залежи образуются на дне озер северного побережья Африки, в Киренаике близ г. Бенгази.

Откуда сероводород в Черном море? Сероводород постоянно образуется на дне Черного моря при взаимодействии растворенных в морской воде сульфатов с органическими веществами: Сероводород постоянно образуется на дне Черного моря при взаимодействии растворенных в морской воде сульфатов с органическими веществами: CaSO 4 + CH 4 => CaS + CO 2 + 2H 2 O CaSO 4 + CH 4 => CaS + CO 2 + 2H 2 O CaS + H 2 O + CO 2 => CaCO 3 + H 2 S В этих реакциях участвуют сульфатвосстанавливающие бактерии. До верхних слоев воды сероводород не доходит, так как на глубине около 150 м он встречается с проникающим сверху кислородом. На этой же глубине обитают серобактерии, помогающие окислить сероводород до серы: 2H 2 S + O 2 => 2H 2 O + 2S 2H 2 S + O 2 => 2H 2 O + 2S В последние годы в связи с катастрофическим загрязнением Черного моря верхняя граница пребывания сероводорода постепенно поднимается, убивая на своем пути все живое. Смертельная граница уже достигла глубина 40 м.
CaS + CO 2 + 2H 2 O CaSO 4 + CH 4 => CaS + CO 2 + 2H 2 O CaS + H 2 O + CO 2 => CaCO 3 + H 2 S В этих реакциях участвуют сульфатвосстанавливающие бактерии. До верхних слоев воды сероводород не доходит, так как на глубине около 150 м он встречается с проникающим сверху кислородом. На этой же глубине обитают серобактерии, помогающие окислить сероводород до серы: 2H 2 S + O 2 => 2H 2 O + 2S 2H 2 S + O 2 => 2H 2 O + 2S В последние годы в связи с катастрофическим загрязнением Черного моря верхняя граница пребывания сероводорода постепенно поднимается, убивая на своем пути все живое. Смертельная граница уже достигла глубина 40 м.">


FeSO 4 + H 2 S FeS + H 2 SO 4 => FeSO 4 + H 2 S 2. Синтезом из серы и водорода: H 2 + S =>" title="Сероводород можно получить 1. В лаборатории сероводород получают взаимодействием сульфида железа с соляной или разбавленной серной кислотами: FeS + H 2 SO 4 => FeSO 4 + H 2 S FeS + H 2 SO 4 => FeSO 4 + H 2 S 2. Синтезом из серы и водорода: H 2 + S =>" class="link_thumb"> 10 Сероводород можно получить 1. В лаборатории сероводород получают взаимодействием сульфида железа с соляной или разбавленной серной кислотами: FeS + H 2 SO 4 => FeSO 4 + H 2 S FeS + H 2 SO 4 => FeSO 4 + H 2 S 2. Синтезом из серы и водорода: H 2 + S => H 2 S H 2 + S => H 2 S 3. Взаимодействием сульфида алюминия с водой алюминия с водой (эта реакция отличается (эта реакция отличается чистотой полученного сероводорода): чистотой полученного сероводорода): Al 2 S 3 +6H 2 O => 3H 2 S+2Al(OH) 3 FeSO 4 + H 2 S FeS + H 2 SO 4 => FeSO 4 + H 2 S 2. Синтезом из серы и водорода: H 2 + S =>"> FeSO 4 + H 2 S FeS + H 2 SO 4 => FeSO 4 + H 2 S 2. Синтезом из серы и водорода: H 2 + S => H 2 S H 2 + S => H 2 S 3. Взаимодействием сульфида алюминия с водой алюминия с водой (эта реакция отличается (эта реакция отличается чистотой полученного сероводорода): чистотой полученного сероводорода): Al 2 S 3 +6H 2 O => 3H 2 S+2Al(OH) 3"> FeSO 4 + H 2 S FeS + H 2 SO 4 => FeSO 4 + H 2 S 2. Синтезом из серы и водорода: H 2 + S =>" title="Сероводород можно получить 1. В лаборатории сероводород получают взаимодействием сульфида железа с соляной или разбавленной серной кислотами: FeS + H 2 SO 4 => FeSO 4 + H 2 S FeS + H 2 SO 4 => FeSO 4 + H 2 S 2. Синтезом из серы и водорода: H 2 + S =>"> title="Сероводород можно получить 1. В лаборатории сероводород получают взаимодействием сульфида железа с соляной или разбавленной серной кислотами: FeS + H 2 SO 4 => FeSO 4 + H 2 S FeS + H 2 SO 4 => FeSO 4 + H 2 S 2. Синтезом из серы и водорода: H 2 + S =>">
Удобный способ. Однажды на лекции демонстрировался опыт: плавление серы в пробирке. Вдруг все почувствовали отвратительный запах. Лекция была сорвана. Однажды на лекции демонстрировался опыт: плавление серы в пробирке. Вдруг все почувствовали отвратительный запах. Лекция была сорвана. Все оказалось просто: в пробирку с серой попали кусочки парафина с пробковой крышки склянки, в которой хранился порошок серы. Смесь парафина и серы при нагревании выделяет сероводород: Все оказалось просто: в пробирку с серой попали кусочки парафина с пробковой крышки склянки, в которой хранился порошок серы. Смесь парафина и серы при нагревании выделяет сероводород: C 20 H S => 21H 2 S + 20C C 20 H S => 21H 2 S + 20C Чем сильнее нагревается смесь, Чем сильнее нагревается смесь, тем активнее выделяется газ. Если нагревание прекратить, Если нагревание прекратить, то реакция останавливается, и сероводород не выделяется. и сероводород не выделяется. Поэтому реакция очень удобна для получения сероводорода в учебных лабораториях. в учебных лабораториях.
21H 2 S + 20C C 20 H 42 + 21S => 21H 2 S + 20C Чем сильнее нагревается смесь, Чем сильнее нагревается смесь, тем активнее выделяется газ. Если нагревание прекратить, Если нагревание прекратить, то реакция останавливается, и сероводород не выделяется. и сероводород не выделяется. Поэтому реакция очень удобна для получения сероводорода в учебных лабораториях. в учебных лабораториях.">

Физические свойства серы Сероводоро́д (серни́стый водоро́д, сульфи́д водоро́да) бесцветный газ с запахом тухлых яиц и сладковатым вкусом. Плохо растворим в воде, хорошо в этаноле. Ядовит. Термически неустойчив (при температурах больше 400 °C разлагается на простые вещества S и H 2). Сероводород малорастворим в воде. При t = 20 º в одном объеме воды растворяется 2,4 объема сероводорода, этот раствор называют сероводородной водой или слабой сероводородной кислотой. Сероводоро́д (серни́стый водоро́д, сульфи́д водоро́да) бесцветный газ с запахом тухлых яиц и сладковатым вкусом. Плохо растворим в воде, хорошо в этаноле. Ядовит. Термически неустойчив (при температурах больше 400 °C разлагается на простые вещества S и H 2). Сероводород малорастворим в воде. При t = 20 º в одном объеме воды растворяется 2,4 объема сероводорода, этот раствор называют сероводородной водой или слабой сероводородной кислотой. Раствор сероводорода в воде очень слабая сероводородная кислота. Раствор сероводорода в воде очень слабая сероводородная кислота.




Качественная реакция на сульфид-ион Лабораторный опыт Лабораторный опыт Pb(NO 3) 2 + Na 2 S PbS + 2NaNO 3 осадок черного цвета осадок черного цвета (Na 2 S + CuCl 2 CuS + 2HCl) осадок черного цвета осадок черного цвета написать полное ионное и краткое ионное уравнение

Сероводород обладает свойствами восстановителя Сероводород горит на воздухе голубым пламенем при этом образуется сернистый газ или оксид серы(IV) 2H 2 S O 2 2H 2 O + 2S +4 O 2 2H 2 S O 2 2H 2 O + 2S +4 O 2 S -2 -6е S +4 Восстановитель O 2 +4е 2O -2 Окислитель При недостатке кислорода образуются пары воды и серы: При недостатке кислорода образуются пары воды и серы: 2H 2 S -2 + O 2 2H 2 O + 2S 0 S -2 -2е S 0 Восстановитель O 2 +4е 2O -2 Окислитель O 2 +4е 2O -2 Окислитель Сероводород обладает свойствами восстановителя: если в пробирку с сероводородом прилить небольшое количество йодной воды, то раствор обесцветится и на поверхности раствора появится сера H 2 S -2 + I 0 2 S 0 + 2HI -1 S -2 -2е S 0 Восстановитель I е 2I -1 окислитель I е 2I -1 окислитель

Влияние сероводорода на окружающую среду и здоровье человека Очень токсичен. Вдыхание воздуха с содержанием сероводорода вызывает головокружение, головную боль, тошноту, а со значительной концентрацией приводит к коме, судорогам, отёку лёгких и даже к летальному исходу. При высокой концентрации однократное вдыхание может вызвать мгновенную смерть. При небольших концентрациях довольно быстро возникает адаптация к неприятному запаху «тухлых яиц», и он перестаёт ощущаться. Во рту возникает сладковатый металлический привкус При большой концентрации ввиду паралича обонятельного нерва запах сероводорода не ощущается При большой концентрации ввиду паралича обонятельного нерва запах сероводорода не ощущается

Применение. Сероводород из-за своей токсичности находит ограниченное применение. В аналитической химии сероводород и сероводородная вода используются как реагенты для осаждения тяжёлых металлов, сульфиды которых очень слабо растворимы. В медицине в составе природных и искусственных сероводородных ванн, а также в составе некоторых минеральных вод. Сероводород применяют для получения серной кислоты, элементной серы, сульфидов. Используют в органическом синтезе для получения тиофена и меркаптанов. Окрашенные сульфиды служат основой для изготовления красок, в том числе светящихся. Они же используются в аналитической химии. Сульфиды калия, стронция и бария используются в кожевенном деле для удаления шерсти со шкур перед их выделкой. Сульфиды калия, стронция и бария используются в кожевенном деле для удаления шерсти со шкур перед их выделкой. В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического (сероводородная энергетика) и химического сырья



 Сероводород в природе Входит в состав вулканических газов. Образуется при гниении белков. Встречается в минеральных источниках (Мацеста, Пятигорск, Кавказ).
Сероводород в природе Входит в состав вулканических газов. Образуется при гниении белков. Встречается в минеральных источниках (Мацеста, Пятигорск, Кавказ).
 Сероводород, сернистый водород (H 2 S) - бесцветный газ с резким запахом. Химическая формула H 2 S Отн. молек. масса 34. 082 а. е. м. Молярная масса 34. 082 г/моль Температура плавления -82. 30 °C Температура кипения -60. 28 °C Плотность вещества 1. 363 г/л г/см 3 Растворимость 0. 25 (40 °C) г/100 мл Состояние (ст. усл) бесцветный газ
Сероводород, сернистый водород (H 2 S) - бесцветный газ с резким запахом. Химическая формула H 2 S Отн. молек. масса 34. 082 а. е. м. Молярная масса 34. 082 г/моль Температура плавления -82. 30 °C Температура кипения -60. 28 °C Плотность вещества 1. 363 г/л г/см 3 Растворимость 0. 25 (40 °C) г/100 мл Состояние (ст. усл) бесцветный газ
 Физические свойства Газ, без цвета, с запахом тухлых яиц, ядовит (в больших концентрациях без запаха), тяжелее воздуха, растворим в воде (в 1 V H 2 O растворяется 2, 4 V H 2 S при н. у.); t°пл = -86°C; t°кип = -60°С. Ядовит! Способен взаимодействовать с железом, входящим в гемоглобин крови. Работать с сероводородом в вытяжном шкафу и герметичных приборах!
Физические свойства Газ, без цвета, с запахом тухлых яиц, ядовит (в больших концентрациях без запаха), тяжелее воздуха, растворим в воде (в 1 V H 2 O растворяется 2, 4 V H 2 S при н. у.); t°пл = -86°C; t°кип = -60°С. Ядовит! Способен взаимодействовать с железом, входящим в гемоглобин крови. Работать с сероводородом в вытяжном шкафу и герметичных приборах!
 Влияние сероводорода на организм Очень ядовит. Даже один вздох чистого сероводорода ведет к потере сознания из-за паралича дыхательного центра. Его коварство заключается в том, что после легкого отравления его запах перестает ощущаться. От сероводорода, выделяющегося при извержении Везувия, погиб в 79 г. до н. э. естествоиспытатель Плиний Старший.
Влияние сероводорода на организм Очень ядовит. Даже один вздох чистого сероводорода ведет к потере сознания из-за паралича дыхательного центра. Его коварство заключается в том, что после легкого отравления его запах перестает ощущаться. От сероводорода, выделяющегося при извержении Везувия, погиб в 79 г. до н. э. естествоиспытатель Плиний Старший.
 Получение сероводорода в лаборатории 1) H 2 + S → H 2 S 2) Fe. S 2 + 2 HCl → H 2 S + Fe. Cl 2 cульфид железа (II)
Получение сероводорода в лаборатории 1) H 2 + S → H 2 S 2) Fe. S 2 + 2 HCl → H 2 S + Fe. Cl 2 cульфид железа (II)

 1) Горение сероводорода. Полное сгорание (при избытке O 2) 2 H 2 S-2 + 3 O 2 → 2 S+4 O 2 + 2 H 2 O Неполное сгорание (недостаток O 2) 2 H 2 S-2 + O 2 → 2 S 0 + 2 H 2 O
1) Горение сероводорода. Полное сгорание (при избытке O 2) 2 H 2 S-2 + 3 O 2 → 2 S+4 O 2 + 2 H 2 O Неполное сгорание (недостаток O 2) 2 H 2 S-2 + O 2 → 2 S 0 + 2 H 2 O
 2) Восстановительные свойства (с галогенами, солями, кислородом, кислотами). H 2 S-2 + Br 2 → S 0 + 2 HBr H 2 S-2 + 2 Fe. Cl 3 → 2 Fe. Cl 2 + S 0 + 2 HCl
2) Восстановительные свойства (с галогенами, солями, кислородом, кислотами). H 2 S-2 + Br 2 → S 0 + 2 HBr H 2 S-2 + 2 Fe. Cl 3 → 2 Fe. Cl 2 + S 0 + 2 HCl
 3) Взаимодействие с водой. Раствор H 2 S в воде – слабая двухосновная кислота (сероводородная кислота) Диссоциация происходит в две ступени: I ст. H 2 S⇄ H+ + HS- (гидросульфид - ион) II ст. HS- ⇄ H+ + S 2 - (сульфид-ион) Средние соли(сульфиды): Na 2 S – сульфид натрия Средние соли(сульфиды): Ca. S – сульфид кальция Кислые соли(гидросульфиды): Na. HS – гидросульфид натрия Ca(HS)2 – гидросульфид кальция
3) Взаимодействие с водой. Раствор H 2 S в воде – слабая двухосновная кислота (сероводородная кислота) Диссоциация происходит в две ступени: I ст. H 2 S⇄ H+ + HS- (гидросульфид - ион) II ст. HS- ⇄ H+ + S 2 - (сульфид-ион) Средние соли(сульфиды): Na 2 S – сульфид натрия Средние соли(сульфиды): Ca. S – сульфид кальция Кислые соли(гидросульфиды): Na. HS – гидросульфид натрия Ca(HS)2 – гидросульфид кальция
 4) Кислотные свойства. Взаимодействует с основаниями: H 2 S + 2 Na. OH изб. → Na 2 S + 2 H 2 O сульфид натрия H 2 S изб. + Na. OH → Na. HS + H 2 O гидросульфид натрия
4) Кислотные свойства. Взаимодействует с основаниями: H 2 S + 2 Na. OH изб. → Na 2 S + 2 H 2 O сульфид натрия H 2 S изб. + Na. OH → Na. HS + H 2 O гидросульфид натрия
 5) Качественная реакция на сероводородную кислоту и сульфиды. Н 2 S + Pb(NO 3)2 → Pb. S↓ + 2 HNO 3 Pb 2+ + S 2 - → Pb. S↓ черный H 2 S + Cu(NO 3)2 → Cu. S↓ + 2 HNO 3 Сu 2+ + S 2 - → Cu. S↓ черный
5) Качественная реакция на сероводородную кислоту и сульфиды. Н 2 S + Pb(NO 3)2 → Pb. S↓ + 2 HNO 3 Pb 2+ + S 2 - → Pb. S↓ черный H 2 S + Cu(NO 3)2 → Cu. S↓ + 2 HNO 3 Сu 2+ + S 2 - → Cu. S↓ черный
 Многие сульфиды окрашены и нерастворимы в воде: Pb. S – черный, Cd. S – желтый, Zn. S – белый, Mn. S – розовый, Cu. S – черный, Ni. S – черный.
Многие сульфиды окрашены и нерастворимы в воде: Pb. S – черный, Cd. S – желтый, Zn. S – белый, Mn. S – розовый, Cu. S – черный, Ni. S – черный.
 Применение сероводорода Сероводород из-за своей токсичности находит ограниченное применение. Ø В медицине - в составе природных и искусственных сероводородных ванн (нормализует работу сердца и нервной системы, артериальное давление, используют при кожных заболеваниях. Ø Сероводород применяют для получения серной кислоты, серы, сульфидов.
Применение сероводорода Сероводород из-за своей токсичности находит ограниченное применение. Ø В медицине - в составе природных и искусственных сероводородных ванн (нормализует работу сердца и нервной системы, артериальное давление, используют при кожных заболеваниях. Ø Сероводород применяют для получения серной кислоты, серы, сульфидов.
Сероводород. Сульфиды
Урок химии, 9 класс
Презентацию подготовила
учитель химии
высшей квалификационной категории
МБОУ «Вересаевская средняя школа»
Левицкая Екатерина Николаевна

Актуализация опорных знаний
- Составьте молекулярное и ионные уравнения реакции между растворами:
сульфида железа (II) и серной кислоты
- Какое вещество образуется в результате реакции?

Мотивация к учебной деятельности
Вспомните,
что вы знаете о сероводороде

Сероводород в природе, его физические свойства. Получение сероводорода.

Серная гиена
Ю.Кузнецов «Тайны Чёрного моря»
Трясся Крым двадцать восьмого года,
И вставало море на дыбы,
Испуская, к ужасу народа,
Огненные серные столбы.
Всё прошло.
Опять гуляет пена,
Но с тех пор всё выше,
всё плотней
Сумрачная серная геенна
Подступает к днищам кораблей.

Окислитель или восстановитель?
H + 2 S 2-
S 2- - 2е→ S 0
S 2- - 6е→ S 4+
сероводород обладает свойствами восстановителя,
так как сера , входящая в его состав , имеет минимальную степень окисления -2 и в этом случае может только отдавать электроны

Заполняем таблицу
Свойства
Сероводород
Формула вещества
Тип химической связи
Агрегатное состояние при н.у.
Цвет
Легче или тяжелее воздуха (подтвердить расчётами)
Запах
Растворимость в воде
Физиологическое действие
Нахождение в природе
Получение в лаборатории
Химические свойства сероводорода
Свойства водного раствора сероводорода
Качественная реакция на сульфид -ионы

Горение сероводорода
Сероводород горит
на воздухе голубым пламенем, при этом образуется
сернистый газ, или оксид серы (IV) и вода .
А при недостатке кислорода образуются пары воды и сера .
Работа в парах:
Составьте уравнения этих реакций, расставив коэффициенты методом электронного баланса)

Сероводород - восстановитель
Горение на воздухе (синее пламя):
2H + 2 S -2 + 3O 0 2 = 2S +4 O -2 2 + 2H + 2 O -2
S 2- - 6е→ S 4+
O 0 2 + 4 е = 2 O 2-
Горение при недостатке кислорода:
2H + 2 S -2 + O 0 2 = 2S 0 + 2H + 2 O -2
S 2- - 2е→ S 0
O 0 2 + 4 е = 2 O 2-



Проверь себя!
Na 2 S + CuCl 2 = CuS↓ + 2NaCl
2 Na + + S 2- + Cu 2+ +2Cl - = CuS↓ +2 Na + +2Cl -
S 2- + Cu 2+ = CuS↓
Образуется чёрный осадок – CuS -сульфид меди(II)

Самостоятельная работа
Выполните задание
по учебнику:
на выбор
№ 2,3 стр. 70)


Век живи – век учись!
ВСЕМ:
1) Проработать материал параграфа 19
2) Заполнить оставшиеся графы таблицы
3) Задача № 4, тестовые задания с.70
Творческие задание .
1)Используя Интернет и дополнительную литературу, подготовьте сообщение или презентацию по одной из тем:
«Влияние оксида серы (IV) на организм человека»
«Кислотные дожди»
«Применение оксида серы (IV) »
2) Составить 3-5 тестовых задания по изученному материалу.