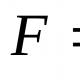Типи хімічних реакцій в органічній хімії – Гіпермаркет знань. Радикальні та іонні механізми реакцій Іонне приєднання до органічної хімії приклади
Додаток 1
МЕХАНІЗМИ РЕАКЦІЙ В ОРГАНІЧНІЙ ХІМІЇ
Н.В.Свіріденкова, НДТУ «МІСіС», Москва
НАВІЩО ВИВЧАТИ МЕХАНІЗМИ ХІМІЧНИХ РЕАКЦІЙ?
Що таке механізм хімічної реакції? Для відповіді це питання розглянемо рівняння реакції спалювання бутену:
C 4 H 8 + 6O 2 = 4CO 2 + 4H 2 O.
Якби реакція насправді протікала так, як це описано в рівнянні, то одна молекула бутену мала зіткнутися одночасно одночасно з шістьма молекулами кисню. Однак навряд чи це відбувається: відомо, що одночасне зіткнення більш як трьох частинок практично неймовірне. Напрошується висновок про те, що ця реакція, як і абсолютна більшість хімічних реакцій, протікає у кілька послідовних стадій. Рівняння реакції показує лише вихідні речовини та кінцевий результат усіх перетворень, і ніяк не пояснює, як утворюються продукти із вихідних речовин. Щоб дізнатися, як саме протікає реакція, які стадії вона включає, які проміжні продукти утворюються, необхідно розглянути механізм реакції.
Отже, механізм реакції- Це детальний опис ходу реакції по стадіях, яке показує, в якому порядку і як розриваються хімічні зв'язки в молекулах, що реагують, і утворюються нові зв'язки і молекули.
Розгляд механізму дозволяє пояснити, чому деякі реакції супроводжуються утворенням декількох продуктів, а в інших реакціях утворюється тільки одна речовина. Знання механізму дозволяє хімікам пророкувати продукти хімічних реакцій доти, як їх провели практично. Нарешті, знаючи механізм реакції, можна керувати ходом реакції: створювати умови збільшення її швидкості підвищення виходу потрібного продукту.
ОСНОВНІ ПОНЯТТЯ: ЕЛЕКТРОФІЛ, НУКЛЕОФІЛ, КАРБОКАТІОН
В органічній хімії реагенти зазвичай ділять на три типи: нуклеофільні, електрофільніі радикальні. З радикалами ви зустрічалися раніше щодо реакцій галогенування алканов. Розглянемо докладніше інші типи реагентів.
Нуклеофільні реагентиабо просто нуклеофіли(у перекладі з грецької «любителі ядер») – це частинки, що мають надлишок електронної щільності, найчастіше негативно заряджені або мають неподілену електронну пару. Нуклеофіли атакують молекули з низькою електронною густиною або позитивно заряджені реагенти. Прикладами нуклеофілів є іони ОН-, Br-, молекули NH3.
Електрофільні реагентиабо електрофіли(у перекладі з грецької «любителі електронів») – це частки з нестачею електронної щільності. Часто електрофіли несуть позитивний заряд. Електрофіли атакують молекули з високою електронною густиною або негативно заряджені реагенти. Приклади електрофілів - Н +, NО 2 +.
Як електрофіл може виступати також несучий частковий позитивний заряд атом полярної молекули. Прикладом може служити атом водню в молекулі HBr, на якому виникає частковий позитивний заряд через зміщення загальної електронної пари зв'язку до атома брому, що має більше значення електронегативності H + + Br - - .
Реакції, що протікають за іонним механізмом, часто супроводжуються утворенням карбокатіонів. Карбокатіономназивають заряджену частинку, що має вільну р-орбіталь на атомі вуглецю Один із атомів вуглецю в карбокатіоні несе на собі позитивний заряд. Прикладами карбокатіонів можуть бути частинки СН 3 -СН 2 + , CH 3 -CH + -CH 3 . Карбокатіони утворюються на одній із стадій у реакціях приєднання до алкенів галогенів і галогеноводородів до алкенів, а також у реакціях заміщення за участю ароматичних вуглеводнів.
МЕХАНІЗМ ПРИЄДНАННЯ ДО НЕМЕЖНИХ ВУГЛЕВОДОРОДІВ
Приєднання галогенів, галогеноводородів, води до ненасичених вуглеводнів (алкенів, алкінів, дієнових вуглеводнів) протікає по іонного механізмузваного електрофільне приєднання.
Розглянемо цей механізм з прикладу реакції приєднання бромоводню до молекули етилену.
Незважаючи на те, що реакція гідробромування описується дуже простим рівнянням її механізм включає кілька стадій.
Стадія 1На першій стадії молекула галогеноводороду утворює з π -електронною хмарою подвійного зв'язку нестійку систему – « π -комплекс» за рахунок часткової передачі π -електронної густини на атом водню, що несе частковий позитивний заряд

Стадія 2Зв'язок водень-галоген розривається з утворенням електрофільної частки Н + і нуклеофільної частки Br - . Електрофіл Н +, що звільнився, приєднується до алкену за рахунок електронної пари подвійного зв'язку, утворюючи σ
-комплекс - карбокатіон.

Стадія 3На цій стадії до позитивно зарядженого карбокатіону приєднується негативно заряджений нуклеофіл з утворенням кінцевого продукту реакції.

ЧОМУ ВИКОНАЄТЬСЯ ПРАВИЛО МАРКІВНИКОВА?
Запропонований механізм добре пояснює утворення переважно одного з продуктів у разі приєднання галогеноводородів до несиметричних алкенів. Нагадаємо, що приєднання галогеноводородів підпорядковується правилу Марковникова, згідно з яким водень приєднується за місцем подвійного зв'язку до найбільш гідрогенізованого атома вуглецю (тобто пов'язаного з найбільшим числом атомів водню), а галоген до найменш гідрогенізованого. Наприклад, при приєднанні бромоводню до пропену переважно утворюється 2-бромпропан:
У реакціях електрофільного приєднання до несиметричних алкенів на другій стадії реакції може утворитися два карбокатіони. Далі реагувати з нуклеофілом, а значить, і визначати продукт реакції буде стійкішим з них.
Розглянемо, які карбокатіони утворюються у разі пропена, та порівняємо їх стійкість. Приєднання протона Н + за місцем подвійного зв'язку може призводити до утворення двох карбокатіонів вторинного та первинного:

Частки, що утворюються, дуже нестабільні, оскільки позитивно заряджений атом вуглецю у складі карбокатіону має нестійку електронну конфігурацію. Такі частки стабілізуються при розподілі (делокалізації) заряду за більшою кількістю атомів. Електронодонорніалкільні групи, що подають електронну щільність на електронодефіцитний атом вуглецю, сприяють та стабілізують карбокатіони. Розглянемо як це відбувається.
Через відмінність електронегативностей атомів вуглецю та водню на атомі вуглецю групи -СН 3 з'являється деякий надлишок електронної щільності, а на атомі водню - деякий її дефіцит С δ-Н 3 δ+ . Наявність такої групи поруч із атомом вуглецю, що несе позитивний заряд, неминуче викликає зміщення електронної густини у бік позитивного заряду. Таким чином, мітильна група виступає як донор, віддаючи частину своєї електронної густини. Про таку групу кажуть, що вона має позитивним індуктивним ефектом (+ I -ефектом). Чим більшою кількістю таких електронодонорних (+ I ) - Замісників оточений вуглець, що несе позитивний заряд, тим більше стійкий відповідний карбокатіон. Таким чином, стабільність карбокатіонів зростає в ряду:

У разі пропену найбільш стійким є вторинний карбокатіон, тому що в ньому позитивно заряджений атом вуглецю карбокатіону стабілізовано двома + I - ефектами сусідніх метильних груп Переважно утворюється та реагує далі саме він. Нестійкий первинний карбокатіон, мабуть, існує дуже короткий час, так що за час свого життя не встигає приєднати нуклеофіл і утворити продукт реакції.

При приєднанні на останній стадії бромід-іону до вторинного карбокатіону і утворюється 2-бромпропан:
ЧИ ЗАВЖДИ ВИКОНАЄТЬСЯ ПРАВИЛО МАРКОВНИКОВА?
Розгляд механізму реакції гідробромування пропілену дозволяє сформулювати загальне правило електрофільного приєднання: «при взаємодії несиметричних алкенів з електрофільними реагентами, реакція протікає через утворення найбільш стабільного карбокатіону». Це правило дозволяє пояснити освіту у деяких випадках продуктів приєднання всупереч правилу Марковникова. Так, приєднання галогеноводородів до трифторпропілену формально протікає проти правила Марковнікова:
Як може вийти такий продукт, адже він утворився в результаті приєднання Br – до первинного, а не до вторинного карбокатіону? Протиріччя легко усувається при розгляді механізму реакції і порівнянні стабільності частинок, що проміжно утворюються:

Група -СF 3 містить три електроноакцепторні атоми фтору, що стягують електронну щільність від атома вуглецю. Тому на атомі вуглецю утворюється істотний недолік електронної щільності. Для компенсації часткового позитивного заряду, що виникає, атом вуглецю стягує на себе електронну щільність сусідніх вуглецевих атомів. Таким чином, група -СF 3 є електроноакцепторнийі виявляє негативний індуктивний ефект (- I ) . Більш стійким у цьому випадку виявляється первинний карбокатіон, так як дестабілізуючий вплив групи -CF 3 через дві σ-зв'язку слабшає. А вторинний карбокатіон, дестабілізований сусідньою електроноакцепторною групою CF 3 практично не утворюється.
Аналогічний вплив на приєднання має присутність при подвійному зв'язку електроноакцепторних груп -NO 2 -COOH, -COH і т.д. І тут також утворюється продукт приєднання формально проти правила Марковникова. Наприклад, при приєднанні хлороводню до пропенової (акрилової) кислоти утворюється переважно 3-хлорпропанова кислота:
Таким чином, напрям приєднання до ненасичених вуглеводнів легко встановити, аналізуючи будову вуглеводню. Коротко це можна відобразити такою схемою:

Слід зазначити, що правило Марковнікова виконується лише в тому випадку, якщо реакція йде за іонним механізмом. Під час проведення радикальних реакцій правило Марковникова не виконується. Так, приєднання бромоводню HBr у присутності пероксидів (H 2 O 2 або органічних пероксидів) протікає проти правила Марковнікова:

Додавання пероксидів змінюють механізм реакції, він стає радикальним. На цьому прикладі видно, наскільки важливо знати механізм реакції та умови, в яких він реалізується. Тоді, вибравши відповідні умови проведення реакції, можна направити її за потрібним у даному конкретному випадку механізмом, і отримати саме ті продукти, які потрібні.
МЕХАНІЗМ ЗАМІЩЕННЯ АТОМІВ ВОДОРОДУ В АРОМАТИЧНИХ КУТОВОДОРОДАХ
Наявність у молекулі бензолу стійкої сполученої π
-електронна система робить реакції приєднання практично неможливими. Для бензолу та його похідних найбільш характерні реакції заміщення атомів водню, що протікають із збереженням ароматичності. При цьому бензольна ядро, що містить π-
електрони, взаємодіє з електрофільними частинками. Такі реакції називають реакціями електрофільного заміщення в ароматичному ряді. До них відносяться, наприклад, галогенування, нітрування та алкілування бензолу та його похідних.
Всі реакції електрофільного заміщення в ароматичних вуглеводнях протікають по тому самому іонномумеханізму незалежно від характеру реагенту. Механізм реакцій заміщення включає кілька стадій: освіта електрофільного агента Е+, освіта π -комплексу, потім σ- комплексу та, нарешті, розпад σ- комплексу із заснуванням продукту заміщення.
Електрофільна частка Е + утворюється при взаємодії реагенту з каталізатором, наприклад, при дії молекули галогену хлоридом алюмінію. Частка Е +, що утворюється, взаємодіє з ароматичним ядром, утворюючи спочатку π -, а потім σ- комплекс:

При освіті σ- комплексу електрофільна частка Е + приєднується до одного з атомів вуглецю бензольного кільця за допомогою σ- зв'язку. У карбокатионе, що утворився, позитивний заряд рівномірно розподілений (делокалізований) між п'ятьма атомами вуглецю, що залишилися.
Реакція закінчується відщепленням протону від σ- комплексу. При цьому два електрони σ -зв'язки С-Н повертаються в цикл, і стійка шестиелектронна ароматична π -Система регенірується.
У молекулі бензолу усі шість атомів вуглецю рівноцінні. Заміщення атома водню може відбуватися з рівною ймовірністю за будь-якого з них. А як відбуватиметься заміщення у разі гомологів бензолу? Розглянемо як приклад метилбензол (толуол).
З експериментальних даних відомо, що електрофільне заміщення у разі толуолу завжди протікає з утворенням двох продуктів. Так, нітрування толуолу протікає з утворенням п-нітротолуолу та про-нітротолуолу:

Аналогічно протікають інші реакції електрофільного заміщення (бромування, алкілування). Також було встановлено, що у разі толуолу реакції заміщення протікають швидше і більш м'яких умовах, ніж у разі бензолу.
Пояснити ці факти дуже просто. Метильна група є електронодонорною і внаслідок цього додатково збільшує електронну густину бензольного кільця. Особливо сильне збільшення електронної щільності відбувається в про-і п-положеннях по відношенню до групи -СН 3 що полегшує приєднання саме в ці місця позитивно зарядженої електрофільної частинки. Тому швидкість реакції заміщення в цілому збільшується, а заступник спрямовується переважно в орто- І пара-Положення.
Реакції органічних речовин можна формально розділити на чотири основні типи: заміщення, приєднання, відщеплення (елімінування) та перегрупування (ізомеризації). Очевидно, що все різноманіття реакцій органічних сполук неможливо звести до запропонованої класифікації (наприклад, реакції горіння). Однак така класифікація допоможе встановити аналогії з вже знайомими вам реакціями, що протікають між неорганічними речовинами.
Як правило, основне органічне з'єднання, що бере участь в реакції, називають субстратом, а інший компонент реакції умовно розглядають як реагент.
Реакції заміщення
Реакції заміщення- це реакції, у яких здійснюється заміна одного атома чи групи атомів у вихідній молекулі (субстраті) інші атоми чи групи атомів.
В реакції заміщення вступають граничні та ароматичні сполуки, такі як алкани, циклоалкани або арени. Наведемо приклади таких реакцій.
Під дією світла атоми водню в молекулі метану здатні заміщатися на атоми галогену, наприклад, атоми хлору:
Іншим прикладом заміщення водню на галоген є перетворення бензолу на бромбензол:

Рівняння цієї реакції може бути записано інакше:
![]()
При цій формі запис реагенти, каталізатор, умови проведення реакції записують над стрілкою, а неорганічні продукти реакції - під нею.
Внаслідок реакцій заміщення в органічних речовин утворюються не просте та складне речовини, як у неорганічній хімії, а два складні речовини.
Реакції приєднання
Реакції приєднання- Це реакції, в результаті яких дві або більше молекул реагуючих речовин з'єднуються в одну.
У реакції приєднання вступають ненасичені сполуки, такі як алкени або алкіни. Залежно від того, яка молекула виступає як реагент, розрізняють гідрування (або відновлення), галогенування, гідрогалогенування, гідратацію та інші реакції приєднання. Кожна з них потребує певних умов.
1.Гідрування- реакція приєднання молекули водню щодо кратного зв'язку:
2. Гідрогалогенування- реакція приєднання галогенводню (гідрохлорування):
3. Галогенування- реакція приєднання галогену:
![]()
4.Полімеризація- особливий тип реакцій приєднання, в ході яких молекули речовини з невеликою молекулярною масою з'єднуються одна з одною з утворенням молекул речовини з дуже високою молекулярною масою - макромолекул.
Реакції полімеризації - це процеси з'єднання безлічі молекул низькомолекулярної речовини (мономіра) у великі молекули (макромолекули) полімеру.
Прикладом реакції полімеризації може бути отримання поліетилену з етилену (етену) під дією ультрафіолетового випромінювання і ініціатора радикального полімеризації R.
Найбільш характерний для органічних сполук ковалентний зв'язок утворюється при перекриванні атомних орбіталей та утворенні загальних електронних пар. Внаслідок цього утворюється загальна для двох атомів орбіталь, на якій знаходиться загальна електронна пара. При розриві зв'язку доля цих електронів може бути різною.
Типи реакційноздатних частинок
Орбіталь з неспареним електроном, що належить одному атому, може перекриватися з орбіталлю іншого атома, де також знаходиться неспарений електрон. При цьому відбувається утворення ковалентного зв'язку щодо обмінного механізму:
Обмінний механізм утворення ковалентного зв'язку реалізується у разі, якщо загальна електронна пара утворюється з неспарених електронів, що належать різним атомам.
Процесом, протилежним утворенню ковалентного зв'язку з обмінного механізму, є розрив зв'язку, при якому до кожного атома відходить по одному електрону (). Внаслідок цього утворюються дві незаряджені частинки, що мають неспарені електрони:
![]()
Такі частки називаються вільними радикалами.
Вільні радикали- Атоми або групи атомів, що мають неспарені електрони.
Вільнорадикальні реакції- це реакції, які протікають під дією та за участю вільних радикалів.
У курсі неорганічної хімії це реакції взаємодії водню із киснем, галогенами, реакції горіння. Реакції цього відрізняються високою швидкістю, виділенням великої кількості тепла.
Ковалентний зв'язок може утворитися і за донорно-акцепторним механізмом. Одна з орбіталей атома (або аніону), на якій знаходиться неподілена електронна пара, перекривається із незаповненою орбіталлю іншого атома (або катіону), що має незаповнену орбіталь, при цьому формується ковалентний зв'язок, наприклад:
![]()
Розрив ковалентного зв'язку призводить до утворення позитивно та негативно заряджених частинок (); оскільки в даному випадку обидва електрони із загальної електронної пари залишаються при одному з атомів, в іншого атома виходить незаповнена орбіталь:
![]()
Розглянемо електролітичну дисоціацію кислот:
![]()
Можна легко здогадатися, що частка, що має неподілену електронну пару R: — , тобто негативно заряджений іон, буде притягуватися до позитивно заряджених атомів або атомів, на яких існує принаймні частковий або ефективний позитивний заряд.
Частинки з неподіленими електронними парами називають нуклеофільними агентами (Nucleus- "Ядро", позитивно заряджена частина атома), тобто "друзями" ядра, позитивного заряду.
Нуклеофіли(Nu) - аніони або молекули, що мають неподілену пару електронів, що взаємодіють з ділянками молекул, на яких зосереджено ефективний позитивний заряд.
Приклади нуклеофілів: Сl - (хлорид-іон), ВІН - (гідроксід-аніон), СН 3 O - (метоксид-аніон), СН 3 СОО - (ацетат-аніон).
Частинки, що мають незаповнену орбіталь, навпаки, прагнутимуть заповнити її і, отже, притягуватимуться до ділянок молекул, на яких присутня підвищена електронна щільність, негативний заряд, неподілена електронна пара. Вони є електрофілами, «друзями» електрона, негативного заряду чи частинок із підвищеною електронною щільністю.
Електрофіли- катіони або молекули, що мають незаповнену електронну орбіталь, які прагнуть заповнення її електронами, оскільки це призводить до більш вигідної електронної конфігурації атома.
Електрофілом із незаповненою орбіталлю є не будь-яка частка. Так, наприклад, катіони лужних металів мають конфігурацію інертних газів і не прагнуть придбання електронів, оскільки мають низьке спорідненість до електрона.
З цього можна зробити висновок, що незважаючи на наявність у них незаповненої орбіталі, подібні частки не будуть електрофілами.
Основні механізми перебігу реакцій
Виділено три основні типи реагуючих частинок - вільні радикали, електрофіли, нуклеофіли - та три відповідні їм типи механізму реакцій:
- вільнорадикальні;
- електрофільні;
- нулеофільні.
Крім класифікації реакцій на кшталт реагуючих частинок, в органічній хімії розрізняють чотири види реакцій за принципом зміни складу молекул: приєднання, заміщення, відщеплення, або елімінування (від англ. to eliminate- видаляти, відщеплювати) та перегрупування. Так як приєднання та заміщення можуть відбуватися під дією всіх трьох типів реакційноздатних частинок, можна виділити кілька основнихмеханізмів перебігу реакцій.


Крім того, розглянемо реакції відщеплення, або елімінування, що йдуть під впливом нуклеофільних частинок – основ.
6. Елімінування:
Відмінною рисою алкенів (ненасичених вуглеводнів) є здатність вступати в реакції приєднання. Більшість цих реакцій протікає механізмом електрофільного приєднання.
Гідрогалогенування (приєднання галогену водню):
При приєднанні галогенводню до алкену водень приєднується до більш гідрованого атома вуглецю, тобто атома, при якому знаходиться більше атомів водню, а галоген - до менш гідрованого.
Утворюється при перекриванні атомних орбіталей та утворенні загальних електронних пар. Внаслідок цього утворюється загальна для двох атомів орбіталь, на якій знаходиться загальна пара електронів. При розриві зв'язку доля цих електронів може бути різною.
Обмінний механізм утворення ковалентного зв'язку. Гомолітичний розрив зв'язку
Орбіталь з неспареним електроном, що належить одному атому, може перекриватися з орбіталлю іншого атома, де також знаходиться неспарений електрон. При цьому відбувається утворення ковалентного зв'язку щодо обмінного механізму:
Н · + · Н -> Н: Н, або Н-Н
Обмінний механізм утворення ковалентного зв'язку реалізується у разі, якщо загальна електронна пара утворюється з неспарених електронів, що належать різним атомам.
p align="justify"> Процесом, протилежним утворенню ковалентного зв'язку по обмінному механізму, є розрив зв'язку, при якому до кожного атома відходить по одному електрону. Внаслідок цього утворюються дві незаряджені частинки, що мають неспарені електрони:
Такі частки називаються вільними радикалами.
Вільні радикали- Атоми або групи атомів, що мають неспарені електрони.
Механізм розриву ковалентного зв'язку, у якому утворюються вільні радикали, називається гемолітичним чи гомолізом (гомо - однаковий, т. е. такий тип розриву зв'язку призводить до утворення однакових частинок).
Реакції, що протікають під дією та за участю вільних радикалів, називаються вільнорадикальними реакціями.
Гідроксил-аніон притягується до атома вуглецю (атакує атом вуглецю), на якому зосереджено частковий позитивний заряд, і заміщає бром, точніше, бромід-аніон.
У молекулі 1-хлорпропану електронна пара у зв'язку С-Сl зміщена у бік атома хлору внаслідок його більшої електронегативності. При цьому атом вуглецю, що отримав частковий позитивний заряд (§+), відтягує електрони від зв'язаного з ним атома вуглецю, який, у свою чергу, від наступного:
![]()
Таким чином, індуктивний ефект передається ланцюгом, але швидко згасає: він практично не спостерігається вже через три ст-зв'язки.
Розглянемо іншу реакцію – приєднання бромоводню до етену:
СН2 = СН2 + НВr -> СН3-СН2Вr
На початковій стадії цієї реакції відбувається приєднання катіону водню до молекули, що містить кратний зв'язок:
СН2 = СН2 + Н + -> СН2-СН3
Електрони л-зв'язку змістилися одного атома вуглецю, на сусідньому виявився позитивний заряд, незаповнена орбіталь.
Стійкість подібних частинок визначається тим, наскільки добре компенсовано позитивний заряд на атомі вуглецю. Ця компенсація відбувається за рахунок усунення електронної щільності а-зв'язку у бік позитивно зарядженого атома вуглецю, тобто позитивного індуктивного ефекту (+1). 
Група атомів, у даному випадку метильна група, від якої електронна щільність відтягується, має донорний ефект, який позначається +1.
Мезомірний ефект. Існує інший спосіб впливу одних атомів чи груп на інші – мезомерний ефект, або ефект сполучення.
Розглянемо молекулу бутадієну-1,3:
СН2 = СН СН = СН2
Виявляється, що подвійні зв'язки у цій молекулі – це не просто два подвійні зв'язки! Так як вони знаходяться поруч, відбувається перекриття п-зв'язків, що входять до складу сусідніх подвійних, та утворюється загальне для всіх чотирьох атомів вуглецю п-електронна хмара. У цьому система (молекула) стає стійкішою. Це явище називається поєднанням (в даному випадку п - п-Сполученням). 
Додаткове перекривання, сполучення л-зв'язків, розділених одним зв'язком, призводить до їх «усереднення». Центральний простий зв'язок набуває часткового «подвійного» характеру, стає міцнішим і коротшим, а подвійні - дещо слабшають і подовжуються.
Іншим прикладом сполучення може бути вплив подвійного зв'язку на атом, що має неподілену електронну пару.
Так, наприклад, при дисоціації карбонової кислоти неподілена електронна пара залишається на атомі кисню:

Це призводить до підвищення стійкості аніону, що утворився при дисоціації, збільшення сили кислоти.
Зміщення електронної щільності у сполучених системах за участю п-зв'язків або неподілених електронних пар називається мезомерним ефектом (М).
Основні механізми перебігу реакцій
Ми виділили три основні типи реагуючих частинок - вільні радикали, електрофіли, нуклеофіли та три відповідні їм типи механізмів реакцій:
Вільнорадикальні;
електрофільні;
нуклеофілні.
Крім класифікації реакцій на кшталт реагуючих частинок, в органічній хімії розрізняють чотири виду реакцій за принципом зміни складу молекул: приєднання, заміщення, відщеплення, або елімінування (від англ. to eliminate - видаляти, відщеплювати), і перегрупування. Так як приєднання і заміщення можуть відбуватися під дією всіх трьох типів реакційноподібних частинок, можна виділити кілька основних механізмів перебігу реакцій.

Крім цього, ми розглянемо реакції відщеплення, або елімінування, що йдуть під впливом нуклеофільних частинок – основ.
1. Що таке гомолітичний та гетеролітичний розриви ковалентного зв'язку? Для яких механізмів утвору ковалентного зв'язку вони характерні?
2. Що називають електрофілами та нуклеофілами? Наведіть їхні приклади.
3. У чому різниця між мезомерним та індуктивним ефектами? Як ці явища ілюструють положення теорії будови органічних сполук А. М. Бутлерова про взаємний вплив атомів у молекулах органічних речовин?
4. У світлі уявлень про індуктивний і мезомерний ефект розгляньте взаємний вплив атомів у молекулах:

Підтвердьте висновки прикладами рівнянь хімічних реакцій.
Зміст уроку конспект урокуопорний каркас презентація уроку акселеративні методи інтерактивні технології Практика завдання та вправи самоперевірка практикуми, тренінги, кейси, квести домашні завдання риторичні питання від учнів Ілюстрації аудіо-, відеокліпи та мультимедіафотографії, картинки графіки, таблиці, схеми гумор, анекдоти, приколи, комікси притчі, приказки, кросворди, цитати Доповнення рефератистатті фішки для допитливих шпаргалки підручники основні та додаткові словник термінів інші Удосконалення підручників та уроківвиправлення помилок у підручникуоновлення фрагмента у підручнику елементи новаторства на уроці заміна застарілих знань новими Тільки для вчителів ідеальні урокикалендарний план на рік методичні рекомендації програми обговорення Інтегровані урокиМеханізми органічних реакцій
| Найменування параметру | Значення |
| Тема статті: | Механізми органічних реакцій |
| Рубрика (тематична категорія) | Освіта |
Класифікація реакцій
Існують чотири основні типи реакцій, у яких беруть участь органічні з'єднання: заміщення (витіснення), приєднання, елімінування (відщеплення), перегрупування.
3.1 Реакції заміщення
У реакціях першого типу заміщення зазвичай відбувається у атома вуглецю, але заміщений атом має бути атомом водню або іншим атомом або групою атомів. При електрофільному заміщенні найчастіше заміщується атом водню; прикладом служить класичне ароматичне заміщення:
При нуклеофільному заміщенні частіше заміщається не атом водню, інші атоми, наприклад:
NC - + R-Br → NC-R + BR -
3.2 Реакції приєднання
Реакції приєднання також бувають електрофільними, нуклеофільними або радикальними виходячи з типу частинок, що ініціюють процес. Приєднання до звичайних подвійних вуглець-вуглецевих зв'язків індукується, як правило, електрофілом або радикалом. Наприклад, приєднання HBr
може починатися з атаки подвійного зв'язку протоном Н+ або радикалом Br.
3.3 Реакції елімінування
Реакції елімінування по суті зворотні реакцій приєднання; найбільш звичайний тип такої реакції - відщеплення атома водню та іншого атома або групи від сусідніх атомів вуглецю з утворенням алкенів:
3.4 Реакції перегрупування
Перегрупування також можуть протікати через проміжні з'єднання, що являють собою катіони, аніони або радикали; найчастіше ці реакції йдуть з утворенням карбокатіонів або інших електронодефіцитних частинок. Перегрупування можуть включати істотну перебудову вуглецевого скелета. За стадією власне перегрупування в таких реакціях часто йдуть стадії заміщення, приєднання або відщеплення, що призводять до утворення стабільного кінцевого продукту.
Детальний опис хімічної реакції на стадіях прийнято називати механізмом. З електронної точки зору під механізмом хімічної реакції розуміють спосіб розриву ковалентних зв'язків у молекулах і послідовність станів, через які проходять речовини, що реагують, до перетворення на продукти реакцій.
4.1 Вільно-радикальні реакції
Вільно-радикальні реакції - це хімічні процеси, в яких беруть участь молекули, що мають неспарені електрони. Певні аспекти реакцій вільних радикалів є унікальними порівняно з іншими типами реакцій. Основна відмінність полягає в тому, що багато вільно-радикальних реакцій є ланцюговими. Це означає існування механізму, завдяки якому безліч молекул перетворюється на продукт за допомогою процесу, що повторюється, ініціюється створенням однієї реакційноздатної частинки. Типовий приклад ілюструється за допомогою наступного гіпотетичного механізму:
Стадію, де генерується реакційний інтермедіат, у разі А·, прийнято називати ініціюванням. Ця стадія протікає за високої температури, під впливом УФ чи пероксидів, в неполярних розчинниках. У наступних чотирьох рівняннях цього прикладу повторюється послідовність двох реакцій; вони є фазою розвитку ланцюга. Ланцюгові реакції характеризуються довжиною ланцюга, що відповідає числу стадій розвитку, що припадають на одну стадію ініціювання. Друга стадія протікає одночасним синтезом з'єднання та утворення нового радикалу, який продовжує ланцюг перетворень. Останньою стадією є стадія обриву ланцюга, яка включає будь-яку реакцію, в якій руйнується один з реакційних інтермедіатів, необхідних для розвитку ланцюга. Чим більше стадій обриву ланцюга, тим меншою стає довжина ланцюга.
Вільно-радикальні реакції протікають: 1) на світлі, при високій температурі або у присутності радикалів, що утворюються при розкладанні інших речовин; 2) гальмуються речовинами, що легко реагують з вільними радикалами; 3)протікають у неполярних розчинниках або в паровій фазі; 4) часто мають автокаталітичний та індукційний період перед початком реакції; 5) у кінетичному відношенні є ланцюговими.
Реакції радикального заміщення характерні для алканів, а радикального приєднання – для алкенів та алкінів.
СН 4 + Сl 2 → CH 3 Cl + HCl
CH 3 -CH=CH 2 + HBr → CH 3 -CH 2 -CH 2 Br
CH 3 -C≡CH + HCl → CH 3 -CH=CHCl
З'єднання вільних радикалів між собою та обрив ланцюга відбувається в основному на стінках реактора.
4.2 Іонні реакції
Реакції, у яких відбувається гетеролітичнийрозрив зв'язків і утворюються проміжні частки іонного типу, що називаються іонними реакціями.
Іонні реакції протікають: 1) у присутності каталізаторів (кислот або основ і не схильні до впливу світла або вільних радикалів, зокрема, що виникають при розкладанні пероксидів); 2)не піддаються впливу акцепторів вільних радикалів; 3)на хід реакції впливає природа розчинника; 4) рідко протікають у паровій фазі; 5) кінетично є, в основному, реакціями першого або другого порядку.
За характером реагенту, що діє на молекулу, іонні реакції поділяються на електрофільніі нуклеофільні. Реакції нуклеофільного заміщення характерні для алкіл- та арилгалогенідів,
CH 3 Cl + H 2 O → CH 3 OH + HCl
C 6 H 5 -Cl + H 2 O → C 6 H 5 -OH + HCl
C 2 H 5 OH + HCl → C 2 H 5 Cl + H 2 O
C 2 H 5 NH 2 + CH 3 Cl → CH 3 -NH-C 2 H 5 + HCl
електрофільного заміщення – для алканів у присутності каталізаторів
CH 3 -CH 2 -CH 2 -CH 2 -CH 3 → CH 3 -CH(CH 3)-CH 2 -CH 3
та аренів.
C 6 H 6 + HNO 3 + H 2 SO 4 → C 6 H 5 -NO 2 + H 2 O
Реакції електрофільного приєднання характерні для алкенів
CH 3 -CH=CH 2 + Br 2 → CH 3 -CHBr-CH 2 Br
та алкінів,
CH≡CH + Cl 2 → CHCl=CHCl
нуклеофільного приєднання – для алкінів.
CH 3 -C≡CH + C 2 H 5 OH + NaOH → CH 3 -C(OC 2 H 5)=CH 2
Механізми органічних реакцій - поняття та види. Класифікація та особливості категорії "Механізми органічних реакцій" 2017, 2018.
>> Хімія: Типи хімічних реакцій в органічній хімії
Реакції органічних речовин можна формально розділити на чотири основні типи: заміщення, приєднання, відщеплення (елімінування) та перегрупування (ізомеризації). Очевидно, що все різноманіття реакцій органічних сполук неможливо звести до рамок запропонованої класифікації (наприклад, реакції горіння). Однак така класифікація допоможе встановити аналогії з вже знайомими вам із курсу неорганічної хімії класифікаціями реакцій, що протікають між неорганічними речовинами.
Як правило, основну органічну сполуку, що бере участь у реакції, називають субстратом, а інший компонент реакції умовно розглядають як реагент.
Реакції заміщення
Реакції, у яких здійснюється заміна одного атома чи групи атомів у вихідній молекулі (субстраті) інші атоми чи групи атомів, називаються реакціями заміщення.
В реакції заміщення вступають граничні та ароматичні сполуки, такі, як, наприклад, алкани, циклоалкани або арени.
Наведемо приклади таких реакцій.