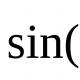Химия органика. Почему вода не горит, хотя состоит из горючих веществ (водорода и кислорода) Когда происходит горение
Кислород — один из самых распространенных на Земле элементов. Он составляет около половины веса земной коры, внешней оболочки планеты. В соединении с водородом он образует воду, покрывающую более двух третей земной поверхности.
Мы не можем ни увидеть кислород, ни ощутить его вкус или запах. Тем не менее, он составляет пятую часть воздуха и является жизненно необходимым. Чтобы жить, нам, так же как животным и растениям, надо дышать.
Кислород — непременный участник химических реакций, идущих внутри любой микроскопической клетки живого организма, в результате которых расщепляются питательные вещества и высвобождается энергия, необходимая для жизни. Именно поэтому кислород так необходим каждому живому существу (за исключением немногих видов микробов).
При горении вещества соединяются с кислородом, выделяя при этом энергию в виде тепла и света.
Водород
Самым распространенным элементом во Вселенной является водород . На него приходится основная масса большинства звезд. На Земле основная часть водорода (химический символ Н) связана с кислородом (О), образуя воду (Н20). Водород — простейший и самый легкий химический элемент, так как каждый его атом состоит лишь из одного протона и одного электрона.
В начале XX века водородом наполняли дирижабли, большие воздушные суда. Однако водород очень легко воспламеняется. После нескольких катастроф, вызванных пожарами, водород в дирижаблях перестали использовать. Сегодня в воздухоплавании используют другой легкий газ — негорючий гелий.
Водород соединяется с углеродом и образует вещества, которые называются углеводородами. К ним относятся продукты, получаемые из природного газа и сырой нефти, например, газообразные пропан и бутан, или жидкий бензин. Водород также соединяется с углеродом и кислородом с образованием углеводов. Крахмал в картофеле и рисе, сахар в свекле являются углеводами.
Солнце и другие звезды в основном состоят из водорода. В центре звезды чудовищные температуры и давления заставляют атомы водорода сливаться друг с другом и превращаться в другой газ - гелий. При этом выделяется огромное количество энергии в виде тепла и света.
10.1.Водород
Название "водород"относится и к химическому элементу, и к простому веществу. Элемент водород состоит из атомов водорода. Простое вещество водород состоит из молекул водорода.
а) Химический элемент водород
В естественном ряду элементов порядковый номер водорода – 1. В системе элементов водород находится в первом периоде в IA или VIIA группе.
Водород – один из самых распространенных элементов на Земле. Молярная доля атомов водорода в атмосфере, гидросфере и литосфере Земли (все вместе это называется земной корой) равна 0,17. Он входит в состав воды, многих минералов, нефти, природного газа, растений и животных. В теле человека в среднем содержится около 7 килограммов водорода.
Существуют три изотопа водорода:
а) легкий водород – протий
,
б) тяжелый водород – дейтерий
(D),
в) сверхтяжелый водород – тритий
(Т).
Тритий неустойчивый (радиоактивный) изотоп, поэтому в природе он практически не встречается. Дейтерий устойчив, но его очень мало: w D = 0,015% (от массы всего земного водорода). Поэтому атомная масса водорода очень мало отличается от 1 Дн (1,00794 Дн).
б) Атом водорода
Из предыдущих разделов курса химии вам уже известны следующие характеристики атома водорода:
Валентные возможности атома водорода
определяются наличием одного электрона на
единственной валентной орбитали. Большая
энергия ионизации делает атом водорода не
склонным к отдаче электрона, а не слишком высокая
энергия сродства к электрону приводит к
незначительной склонности его принимать.
Следовательно, в химических системах
образование катиона Н
невозможно, а соединения с анионом Н не очень устойчивы.
Таким образом, для атома водорода наиболее
характерно образование с другими атомами
ковалентной связи за счет своего одного
неспаренного электрона. И в случае образования
аниона, и в случае образования ковалентной связи
атом водорода одновалентен.
В простом веществе степень окисления атомов
водорода равна нулю, в большинстве соединений
водород проявляет степень окисления +I, и только в
гидридах наименее электроотрицательных
элементов у водорода степень окисления –I.
Сведения о валентных возможностях атома
водорода приведены в таблице 28. Валентное
состояние атома водорода, связанного одной
ковалентной связью с каким-либо атомом, в таблице
обозначено символом "H-".
Таблица 28. Валентные возможности атома водорода
Валентное состояние |
Примеры химических веществ |
|||
I |
HCl, H 2 O, H 2 S, NH 3 ,
CH 4 , C 2 H 6 , NH 4 Cl, H 2 SO 4 ,
NaHCO 3 , KOH |
|||
NaH, KH, CaH 2 , BaH 2 |
в) Молекула водорода
Двухатомная молекула водорода Н 2 образуется при связывании атомов водорода единственной возможной для них ковалентной связью. Связь образуется по обменному механизму. По способу перекрывания электронных облаков это s-связь (рис. 10.1 а ). Так как атомы одинаковы, связь неполярная.

Межатомное расстояние (точнее
равновесное межатомное расстояние, ведь атомы-то
колеблются) в молекуле водорода r
(H–H) = 0,74 A
(рис.10.1 в
), что значительно меньше суммы
орбитальных радиусов (1,06 A). Следовательно,
электронные облака связываемых атомов
перекрываются глубоко (рис. 10.1 б
), и связь в
молекуле водорода прочная. Об этом же говорит и
довольно большое значение энергии связи
(454 кДж/моль).
Если охарактеризовать форму молекулы граничной
поверхностью (аналогичной граничной поверхности
электронного облака), то можно сказать, что
молекула водорода имеет форму слегка
деформированного (вытянутого) шара (рис. 10.1 г
).
г) Водород (вещество)
При обычных условиях водород – газ без
цвета и запаха. В небольших количествах он
нетоксичен. Твердый водород плавится при 14 К (–259
°С), а жидкий водород кипит при 20 К (–253 °С). Низкие
температуры плавления и кипения, очень маленький
температурный интервал существования жидкого
водорода (всего 6 °С), а также небольшие значения
молярных теплот плавления (0,117 кДж/моль) и
парообразования (0,903 кДж/моль) говорят о том, что
межмолекулярные связи в водороде очень слабые.
Плотность водорода r(Н 2) = (2 г/моль):(22,4 л/моль)
= 0,0893 г/л. Для сравнения: средняя плотность
воздуха равна 1,29 г/л. То есть водород в 14,5 раза
"легче"воздуха. В воде он практически
нерастворим.
При комнатной температуре водород малоактивен,
но при нагревании реагирует со многими
веществами. В этих реакциях атомы водорода могут
как повышать, так и понижать свою степень
окисления: Н 2 + 2е
– = 2Н –I , Н 2
– 2е
– = 2Н +I .
В первом случае водород является окислителем,
например, в реакциях с натрием или с кальцием: 2Na +
H 2 = 2NaH, (t
) Ca + H 2 = CaH 2 . (t
)
Но более характерны для водорода
восстановительные свойства: O 2 + 2H 2 = 2H 2 O,
(t
)
CuO + H 2 = Cu + H 2 O. (t
)
При нагревании водород окисляется не только
кислородом, но и некоторыми другими неметаллами,
например, фтором, хлором, серой и даже азотом.
В лаборатории водород получают в результате
реакции
Zn + H 2 SO 4 = ZnSO 4 + H 2 .
Вместо цинка можно использовать железо, алюминий и некоторые другие металлы, а вместо серной кислоты – некоторые другие разбавленные кислоты. Образующийся водород собирают в пробирку методом вытеснения воды (см. рис. 10.2 б ) или просто в перевернутую колбу (рис. 10.2 а ).

В промышленности в больших количествах водород получают из природного газа (в основном это метан) при взаимодействии его с парами воды при 800 °С в присутствии никелевого катализатора:
CH 4 + 2H 2 O = 4H 2 +CO 2 (t , Ni)
или обрабатывают при высокой температуре парами воды уголь:
2H 2 O + С = 2H 2 + CO 2 . (t )
Чистый водород получают из воды, разлагая ее электрическим током (подвергая электролизу):
2H 2 O = 2H 2 + O 2 (электролиз).
д) Соединения водорода
Гидриды (бинарные соединения,
содержащие водород) делятся на два основных типа:
а) летучие
(молекулярные) гидриды,
б) солеобразные (ионные) гидриды.
Элементы IVА – VIIA групп и бор образуют
молекулярные гидриды. Из них устойчивы только
гидриды элементов, образующих неметаллы:
B 2 H 6 ;CH 4 ; NH 3 ; H 2 O;
HF
SiH 4 ;PH 3 ; H 2 S; HCl
AsH 3 ; H 2 Se; HBr
H 2 Te; HI
За исключением воды, все эти соединения при
комнатной температуре – газообразные вещества,
отсюда их название – "летучие гидриды" .
Некоторые из элементов, образующих неметаллы,
входят в состав и более сложных гидридов.
Например, углерод образует соединения с общими
формулами C n
H 2n
+2 , C n
H 2n
,
C n
H 2n
–2 и другие, где n
может
быть очень велико (эти соединения изучает
органическая химия).
К ионным гидридам относятся гидриды щелочных,
щелочноземельных элементов и магния. Кристаллы
этих гидридов состоят из анионов Н и катионов металла в высшей
степени окисления Ме
или Ме 2 (в
зависимости от группы системы элементов).
| LiH | |
| NaH | MgH 2 |
| KH | CaH 2 |
| RbH | SrH 2 |
| CsH | BaH 2 |
И ионные, и почти все молекулярные гидриды (кроме
Н 2 О и НF) являются восстановителями, но
ионные гидриды проявляют восстановительные
свойства значительно сильнее, чем молекулярные.
Кроме гидридов, водород входит в состав
гидроксидов и некоторых солей. Со свойствами
этих, более сложных, соединений водорода вы
познакомитесь в следующих главах.
Главными потребителями получаемого в
промышленности водорода являются заводы по
производству аммиака и азотных удобрений, где
аммиак получают непосредственно из азота и
водорода:
N 2 +3H 2 2NH 3 (Р , t , Pt – катализатор).
В больших количествах водород используют для получения метилового спирта (метанола) по реакции 2Н 2 + СО = СН 3 ОН (t , ZnO – катализатор), а также в производстве хлороводорода, который получают непосредственно из хлора и водорода:
H 2 + Cl 2 = 2HCl.
Иногда водород используют в металлургии в качестве восстановителя при получении чистых металлов, например: Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O.
1.Из
каких частиц состоят ядра а) протия, б) дейтерия,
в) трития?
2.Сравните энергию ионизации атома водорода с
энергией ионизации атомов других элементов. К
какому элементу по этой характеристике водород
ближе всего?
3.Проделайте то же для энергии сродства к
электрону
4.Сравните направление поляризации ковалентной
связи и степень окисления водорода в
соединениях: а) BeH 2 ,CH 4 , NH 3 , H 2 O,
HF; б) CH 4 , SiH 4 ,GeH 4 .
5.Запишите простейшую, молекулярную, структурную
и пространственную формулу водорода. Какая из
них чаще всего используется?
6.Часто говорят: " Водород легче воздуха". Что
под этим подразумевается? В каких случаях это
выражение можно понимать буквально, а в каких
–нет?
7.Составьте структурные формулы гидридов калия и
кальция, а также аммиака, сероводорода и
бромоводорода.
8.Зная молярные теплоты плавления и
парообразования водорода, определите значения
соответствующих удельных величин.
9.Для каждой из четырех реакций, иллюстрирующих
основные химические свойства водорода,
составьте электронный баланс. Отметьте
окислители и восстановители.
10.Определите массу цинка, необходимого для
получения 4,48 л водорода лабораторным способом.
11.Определите массу и объем водорода, который
можно получить из 30 м 3 смеси метана и паров
воды, взятых в объемном отношении 1:2, при выходе 80
%.
12.Составьте уравнения реакций, протекающихпри
взаимодействии водорода а) со фтором, б) с серой.
13.Приведенные ниже схемы реакций иллюстрируют
основные химические свойства ионных гидридов:
а) MH + O 2 MOH (t
); б) MH + Cl 2 MCl + HCl (t
);
в) MH + H 2 O MOH + H 2 ; г) MH + HCl(p) MCl + H 2
Здесь М – это литий, натрий, калий, рубидий или
цезий. Составьте уравнения соответствующих
реакций в случае, если М – натрий.
Проиллюстрируйте уравнениями реакций
химические свойства гидрида кальция.
14.Используя метод электронного баланса,
составьте уравнения следующих реакций,
иллюстрирующих восстановительные свойства
некоторых молекулярных гидридов:
а) HI + Cl 2 HCl + I 2 (t
); б) NH 3 + O 2
H 2 O +
N 2 (t
); в) CH 4 + O 2 H 2 O + CO 2 (t
).
10.2 Кислород
Как и в случае водорода, слово "кислород" является названием и химического элемента, и простого вещества. Кроме простого вещества "кислород" (дикислород) химический элемент кислородобразует еще одно простое вещество, называемое " озон" (трикислород). Это аллотропные модификации кислорода. Вещество кислород состоит из молекул кислорода O 2 , а вещество озон состоит из молекул озона O 3 .
а) Химический элемент кислород
В естественном ряду элементов
порядковый номер кислорода – 8. В системе
элементов кислород находится во втором периоде в
VIA группе.
Кислород – самый распространенный элемент на
Земле. В земной коре каждый второй атом – атом
кислорода, то есть молярная доля кислорода в
атмосфере, гидросфере и литосфереЗемли – около 50
%. Кислород (вещество) – составная часть воздуха.
Объемная доля кислорода в воздухе –21 %. Кислород
(элемент) входит в состав воды, многих минералов,
а также растений и животных. В теле человека
содержится в среднем 43 кг кислорода.
Природный кислород состоит из трех изотопов (16 О,
17 О и 18 О), из которых наиболее
распространен самый легкий изотоп 16 О.
Поэтому атомная масса кислорода близка к 16 Дн
(15,9994 Дн).
б) Атом кислорода
Вам известны следующие характеристики атома кислорода.
Таблица 29. Валентные возможности атома кислорода
Валентное состояние |
Примеры химических веществ |
|||
Al 2 O 3 , Fe 2 O 3 , Cr 2 O 3 * |
||||
–II |
H 2 O, SO 2 , SO 3 ,
CO 2 , SiO 2 , H 2 SO 4 , HNO 2 , HClO 4 ,
COCl 2 , H 2 O 2 |
|||
NaOH, KOH, Ca(OH) 2 , Ba(OH) 2 |
||||
Li 2 O, Na 2 O, MgO, CaO, BaO, FeO, La 2 O 3 |
* Эти оксиды можно рассматривать и как
ионные соединения.
** Атомы кислорода в молекуле не находятся в
данном валентном состоянии; это лишь пример
вещества со степенью окисления атомов кислорода,
равной нулю
Большая энергия ионизации (как у водорода)
исключает образование из атома кислорода
простого катиона. Энергия сродства к электрону
довольно велика (почти в два раза больше, чем у
водорода), что обеспечивает большую склонность
атома кислорода к присоединению электронов и
способность образовывать анионы О 2A . Но
энергия сродства к электрону у атома кислорода
все же меньше, чем у атомов галогенов и даже
других элементов VIA группы. Поэтому анионы
кислорода (оксид-ионы
) существуют только в
соединениях кислорода с элементами, атомы
которых очень легко отдают электроны.
Обобществляя два неспаренных электрона, атом
кислорода может образовать две ковалентные
связи. Две неподеленные пары электронов из-за
невозможности возбуждения могут вступать только
в донорно-акцепторное взаимодействие. Таким
образом, без учета кратности связи и
гибридизации атом кислорода может находиться в
одном из пяти валентных состояний (табл. 29).
Наиболее характерно для атома кислорода
валентное состояние с W
к = 2, то есть
образование двух ковалентных связей за счет двух
неспаренных электронов.
Очень высокая электроотрицательность атома
кислорода (выше – только у фтора) приводит к тому,
что в большинстве своих соединений кислород
имеет степень окисления –II. Существуют вещества,
в которых кислород проявляет и другие значения
степени окисления, некоторые из них приведены в
таблице 29 в качестве примеров, а сравнительная
устойчивость показана на рис. 10.3.

в) Молекула кислорода
Экспериментально установлено, что двухатомная молекула кислорода О 2 содержит два неспаренных электрона. Используя метод валентных связей, такое электронное строение этой молекулы объяснить невозможно. Тем не менее, связь в молекуле кислорода близка по свойствам к ковалентной. Молекула кислорода неполярна. Межатомное расстояние (r o–o = 1,21 A = 121 нм) меньше, чем расстояние между атомами, связанными простой связью. Молярная энергия связи довольно велика и составляет 498 кДж/моль.
г) Кислород (вещество)
При обычных условиях кислород – газ
без цвета и запаха. Твердый кислород плавится при
55 К (–218 °С), а жидкий кислород кипит при 90 К (–183
°С).
Межмолекулярные связи в твердом и жидком
кислороде несколько более прочные, чем в
водороде, о чем свидетельствует больший
температурный интервал существования жидкого
кислорода (36 °С) и большие, чем у водорода,
молярные теплоты плавления (0,446 кДж/моль) и
парообразования (6,83 кДж/моль).
Кислород незначительно растворим в воде: при 0 °С
в 100 объемах воды (жидкой!) растворяется всего 5
объемов кислорода (газа!).
Высокая склонность атомов кислорода к
присоединению электронов и высокая
электроотрицательность приводят к тому, что
кислород проявляет только окислительные
свойства. Эти свойства особенно ярко проявляются
при высокой температуре.
Кислород реагирует со многими металлами: 2Ca + O 2
= 2CaO, 3Fe + 2O 2 = Fe 3 O 4 (t
);
неметаллами: C + O 2 = CO 2, P 4 + 5O 2
= P 4 O 10 ,
и сложными веществами: CH 4 + 2O 2 = CO 2
+ 2H 2 O, 2H 2 S + 3O 2 = 2H 2 O + 2SO 2 .
Чаще всего в результате таких реакций получаются различные оксиды (см. гл. II § 5), но активные щелочные металлы, например натрий, сгорая, превращаются в пероксиды:
2Na + O 2 = Na 2 O 2 .
Структурная формула получившегося
пероксида натрия (Na ) 2 ( O-O ).
Тлеющая лучинка, помещенная в кислород,
вспыхивает. Это удобный и простой способ
обнаружения чистого кислорода.
В промышленности кислород получают из воздуха
путем ректификации (сложной разгонки), а в
лаборатории – подвергая термическому
разложению некоторые кислородсодержащие
соединения, например:
2KMnO 4 = K 2 MnO 4 + MnO 2 + O 2 (200 °С);
2KClO 3 = 2KCl + 3O 2 (150 °С, MnO 2 – катализатор);
2KNO 3 = 2KNO 2 + 3O 2 (400 °С)
и, кроме того, путем каталитического разложения
пероксида водорода при комнатной температуре: 2H 2 O 2
= 2H 2 O + O 2 (MnO 2 –катализатор).
Чистый кислород используют в промышленности для
интенсификации тех процессов, в которых
происходит окисление, и для создания
высокотемпературного пламени. В ракетной
технике в качестве окислителя используется
жидкий кислород.
Огромное значение имеет кислород для
поддержания жизнедеятельности растений,
животных и человека. В обычных условиях человеку
достаточно для дыхания кислорода воздуха. Но в
условиях, когда воздуха не хватает, или он вообще
отсутствует (в самолетах, при водолазных работах,
в космических кораблях и т. п.), для дыхания
готовят специальные газовые смеси, содержащие
кислород. Применяют кислород и в медицине при
заболеваниях, вызывающих затруднение дыхания.
д) Озон и его молекулы
Озон O 3 – вторая аллотропная
модификация кислорода.
Трехатомная молекула озона имеет уголковую
структуру, среднюю между двумя структурами,
отображаемыми следующими формулами:

Озон – темно-синий газ с резким
запахом. Из-за своей сильной окислительной
активности он ядовит. Озон в полтора раза
"тяжелее" кислорода и несколько больше, чем
кислород, растворим в воде.
Озон образуется в атмосфере из кислорода при
грозовых электрических разрядах:
3О 2 = 2О 3 ().
При обычной температуре озон медленно
превращается в кислород, а при нагревании этот
процесс протекает со взрывом.
Озон содержится в так называемом "озоновом
слое" земной атмосферы, предохраняя все живое
на Земле от вредного воздействия солнечного
излучения.
В некоторых городах озон используется вместо
хлора для дезинфекции (обеззараживания) питьевой
воды.
Изобразите структурные формулы следующих
веществ: OF 2 , H 2 O, H 2 O 2 , H 3 PO 4 ,
(H 3 O) 2 SO 4 , BaO, BaO 2 , Ba(OH) 2 .
Назовите эти вещества. Опишите валентные
состояния атомов кислорода в этих соединениях.
Определите валентность и степень окисления
каждого из атомов кислорода.
2.Составьте уравнения реакций сгорания в
кислороде лития, магния, алюминия, кремния,
красного фосфора и селена (атомы селена
окисляются до степени окисления +IV, атомы
остальных элементов – до высшей степени
окисления). К каким классам оксидов относятся
продукты этих реакций?
3.Сколько литров озона можно получить (при
нормальных условиях) а) из 9 л кислорода, б) из 8 г
кислорода?
Вода – самое распространенное в
земной коре вещество. Масса земной воды
оценивается в 10 18 тонн. Вода – основа
гидросферы нашей планеты, кроме того, она
содержится в атмосфере, в виде льда образует
полярные шапки Земли и высокогорные ледники, а
также входит в состав различных горных пород.
Массовая доля воды в человеческом организме
составляет около 70 %.
Вода – единственное вещество, у которого во всех
трех агрегатных состояниях есть свои особые
названия.

Электронное строение молекулы воды
(рис. 10.4 а
) нами было подробно изучено ранее
(см. § 7.10).
Из-за полярности связей О–Н и уголковой формы
молекула воды представляет собой электрический
диполь
.
Для характеристики полярности электрического диполя используется физическая величина, называемая "электрический момент электрического диполя" или просто "дипольный момент" .
В химии дипольный момент измеряют в дебаях: 1 Д = 3,34 . 10 –30 Кл. м
В молекуле воды – две полярные ковалентные связи, то есть два электрических диполя, каждый из которых обладает своим дипольным моментом (и ). Общий дипольный момент молекулы равен векторной сумме этих двух моментов (рис. 10.5):
(Н 2 О) = ![]() ,
,

где q 1 и q 2 – частичные заряды (+) на атомах водорода, а и – межатомные расстояния О – Н в молекуле. Так как q 1 = q 2 = q , а , то
Экспериментально определенные дипольные моменты молекулы воды и некоторых других молекул приведены в таблице.
Таблица 30. Дипольные моменты некоторых полярных молекул
Молекула |
Молекула |
Молекула |
|||
Учитывая дипольный характер молекулы
воды, ее часто схематически изображают следующим
образом:
Чистая вода – бесцветная жидкость без вкуса и
запаха. Некоторые основные физические
характеристики воды приведены в таблице.
Таблица 31. Некоторые физические характеристики воды
Большие значения молярных теплот плавления и парообразования (на порядок больше, чем у водорода и кислорода) свидетельствуют о том, что молекулы воды, как в твердом, так и в жидком веществе, довольно прочно связаны между собой. Эти связи называют "водородными связями" .
ЭЛЕКТРИЧЕСКИЙ
ДИПОЛЬ, ДИПОЛЬНЫЙ МОМЕНТ, ПОЛЯРНОСТЬ СВЯЗИ,
ПОЛЯРНОСТЬ МОЛЕКУЛЫ.
Сколько валентных электронов атома кислорода
принимает участие в образовании связей в
молекуле воды?
2.При перекрывании каких орбиталей образуются
связи между водородом и кислородом в молекуле
воды?
3.Составьте схему образования связей в молекуле
пероксида водорода H 2 O 2 . Что вы можете
сказать о пространственном строении этой
молекулы?
4.Межатомные расстояния в молекулах HF, HCl и HBr
равны, соответственно, 0,92; 1,28 и 1,41. Используя таблицу дипольных
моментов, рассчитайте и сравните между собой
частичные заряды на атомах водорода в этих
молекулах.
5.Межатомные расстояния S – H в молекуле
сероводорода равны 1,34 ,
а угол между связями 92°. Определите значения
частичных зарядов на атомах серы и водорода. Что
вы можете сказать о гибридизации валентных
орбиталей атома серы?
10.4. Водородная связь
Как вы уже знаете, из-за существенной
разницы в электроотрицательности водорода и
кислорода (2,10 и 3,50) у атома водорода в молекуле
воды возникает большой положительный частичный
заряд (q
ч = 0,33 е
), а у атома
кислорода – еще больший отрицательный частичный
заряд (q
ч = –0,66 е
). Вспомним также,
что у атома кислорода есть две неподеленные пары
электронов на sp
3 -гибридных АО. Атом
водорода одной молекулы воды притягивается к
атому кислорода другой молекулы, и, кроме того,
полупустая 1s-АО атома водорода частично
акцептирует пару электронов атома кислорода. В
результате этих взаимодействий между молекулами
возникает особый вид межмолекулярных связей
–водородная связь.
В случае воды образование водородной связи может
быть схематически представлено следующим
образом:

В последней структурной формуле тремя точками (пунктирный штрих, а не электроны!) показана водородная связь.
Водородная связь существует не только
между молекулами воды. Она образуется, если
соблюдаются два условия:
1) в молекуле есть сильно полярная связь Н–Э (Э –
символ атома достаточно электроотрицательного
элемента),
2) в молекуле есть атом Э с большим отрицательным
частичным зарядом и неподеленной парой
электронов.
В качестве элемента Э может быть фтор, кислород и
азот. Существенно слабее водородные связи, если Э
– хлор или сера.
Примеры веществ с водородной связью между
молекулами: фтороводород, твердый или жидкий
аммиак, этиловый спирт и многие другие.

В жидком фтороводороде его молекулы
связаны водородными связями в довольно длинные
цепи, а в жидком и твердом аммиаке образуются
трехмерные сетки.
По прочности водородная связь – промежуточная
между химической связью и остальными видами
межмолекулярных связей. Молярная энергия
водородной связи обычно лежит в пределах от 5 до 50
кДж/моль.
В твердой воде (то есть в кристаллах льда) все
атомы водорода связаны водородными связями с
атомами кислорода, при этом каждый атом
кислорода образует по две водородные связи
(используя обе неподеленные пары электронов).
Такая структура делает лед более " рыхлым"по
сравнению с жидкой водой, где часть водородных
связей оказывается разорванной, и молекулы
получают возможность несколько плотнее "
упаковаться". Эта особенность структуры льда
объясняет, почему, в отличие от большинства
других веществ, вода в твердом состоянии имеет
меньшую плотность, чем в жидком. Максимальной
плотности вода достигает при 4 °С –при этой
температуре рвется достаточно много водородных
связей, а тепловое расширение еще не очень сильно
сказывается на плотности.
Водородные связи имеют очень большое значение в
нашей жизни. Представим себе на минуту, что
водородные связи перестали образовываться. Вот
некоторые последствия:
- вода при комнатной температуре стала бы газообразной, так как ее температура кипения понизилась бы до примерно –80 °С;
- все водоемы стали бы промерзать со дна, так как плотность льда была бы больше плотности жидкой воды;
- перестала бы существовать двойная спираль ДНК и многое другое.
Приведенных примеров достаточно, чтобы понять, что в этом случае природа на нашей планете стала бы совсем иной.
ВОДОРОДНАЯ
СВЯЗЬ, УСЛОВИЯ ЕЕ ОБРАЗОВАНИЯ.
Формула этилового спирта СН 3 –СН 2 –О–Н.
Между какими атомами разных молекул этого
вещества образуются водородные связи? Составьте
структурные формулы, иллюстрирующие их
образование.
2.Водородные связи существуют не только в
индивидуальных веществах, но и в растворах.
Покажите с помощью структурных формул, как
образуются водородные связи в водном растворе а)
аммиака, б) фтороводорода, в) этанола (этилового
спирта).
= 2Н 2 О.
Обе эти реакции протекают в воде постоянно и с
равной скоростью, следовательно, в воде
существует равновесие: 2Н 2 О AН 3 О + ОН .
Это равновесие называется равновесием
автопротолиза
воды.
Прямая реакция этого обратимого
процесса эндотермична, поэтому при нагревании
автопротолиз усиливается, при комнатной же
температуре равновесие сдвинуто влево, то есть
концентрация ионов Н 3 О и ОН
ничтожны. Чему же они равны?
По закону действующих масс
![]()
Но из-за того, что число прореагировавших молекул воды по сравнению с общим числом молекул воды незначительно, можно считать, что концентрация воды при автопротолизе практически не изменяется, и 2 = const Такая низкая концентрация разноименно заряженных ионов в чистой воде объясняет, почему эта жидкость, хоть и плохо, но все же проводит электрический ток.
АВТОПРОТОЛИЗ
ВОДЫ, КОНСТАНТА АВТОПРОТОЛИЗА (ИОННОЕ
ПРОИЗВЕДЕНИЕ) ВОДЫ.
Ионное произведение жидкого аммиака
(температура кипения –33 °С) равно 2·10 –28 .
Составьте уравнение автопротолиза аммиака.
Определите концентрацию ионов аммония в чистом
жидком аммиаке. Электропроводность какого из
веществ больше, воды или жидкого аммиака?
1. Получение водорода и его
горение (восстановительные свойства).
2. Получение кислорода и горение веществ в нем
(окислительные свойства).
§3. Уравнение реакции и как его составить
Взаимодействие водорода
с кислородом
, как это установил еще сэр Генри Кавендиш , приводит к образованию воды.
Давайте на этом простом примере поучимся составлять уравнения химических реакций
.
Что получается из водорода
и кислорода
, мы уже знаем:
Н 2 + О 2 → Н 2 О
Теперь учтем, что атомы химических элементов в химических реакциях не исчезают и не появляются из ничего, не превращаются друг в друга, а соединяются в новых комбинациях , образуя новые молекулы. Значит, в уравнении химической реакции атомов каждого сорта должно быть одинаковое количество до реакции (слева от знака равенства) и после окончания реакции (справа от знака равенства), вот так:
2Н 2 + О 2 = 2Н 2 О
Это и есть уравнение реакции - условная запись протекающей химической реакции с помощью формул веществ и коэффициентов .
Это значит, что в приведенной реакции два моля водорода должны прореагировать с одним молем кислорода , и в результате получится два моля воды .
Взаимодействие водорода с кислородом - совсем не простой процесс. Он приводит к изменению степеней окисления этих элементов. Чтобы подбирать коэффициенты в таких уравнениях, обычно пользуются методом "электронного баланса ".
Когда из водорода и кислорода образуется вода, то это значит, что водород поменял свою степень окисления от 0 до +I , а кислород - от 0 до −II . При этом от атомов водорода к атомам кислорода перешло несколько (n) электронов:
Водород, отдающий электроны, служит здесь восстановителем , а кислород, принимающий электроны - окислителем .
Окислители и восстановители
Посмотрим теперь, как выглядят процессы отдачи и приема электронов по отдельности. Водород , встретившись с "грабителем"-кислородом, теряет все свое достояние - два электрона, и его степень окисления становится равной +I :
Н 2 0 − 2e − = 2Н +I
Получилось уравнение полуреакции окисления водорода.
А бандит-кислород О 2 , отняв последние электроны у несчастного водорода, очень доволен своей новой степенью окисления -II :
O 2 + 4e − = 2O −II
Это уравнение полуреакции восстановления кислорода.
Остается добавить, что и "бандит", и его "жертва" потеряли свою химическую индивидуальность и из простых веществ - газов с двухатомными молекулами Н 2 и О 2 превратились в составные части нового химического вещества - воды Н 2 О .
Дальше будем рассуждать следующим образом: сколько электронов отдал восстановитель бандиту-окислителю, столько тот и получил. Число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем .
Значит, надо уравнять число электронов в первой и второй полуреакциях. В химии принята такая условная форма записи уравнений полуреакций:
2 Н 2 0 − 2e − = 2Н +I |
|
1 O 2 0 + 4e − = 2O −II |
Здесь числа 2 и 1 слева от фигурной скобки - это множители, которые помогут обеспечить равенство числа отданных и принятых электронов. Учтем, что в уравнениях полуреакций отдано 2 электрона, а принято 4. Чтобы уравнять число принятых и отданных электронов, находят наименьшее общее кратное и дополнительные множители. В нашем случае наименьшее общее кратное равно 4. Дополнительные множители будут для водорода равны 2 (4: 2 = 2), а для кислорода - 1 (4: 4 = 1)
Полученные множители и будут служить коэффициентами будущего уравнения реакции:
2H 2 0 + O 2 0 = 2H 2 +I O −II
Водород окисляется не только при встрече с кислородом . Примерно так же на водород действуют и фтор F 2 , галоген и известный "разбойник", и казалось бы, безобидный азот N 2 :
H 2 0 + F 2 0 = 2H +I F −I |
3H 2 0 + N 2 0 = 2N −III H 3 +I |
При этом получается фтороводород HF или аммиак NH 3 .
В обоих соединениях степень окисления водорода становится равной +I , потому что партнеры по молекуле ему достаются "жадные" до чужого электронного добра, с высокой электроотрицательностью - фтор F и азот N . У азота значение электроотрицательности считают равным трем условным единицам, а у фтора вообще самая высокая электроотрицательность среди всех химических элементов - четыре единицы. Так что немудрено им оставить бедняжку-атом водорода без всякого электронного окружения.
Но водород может и восстанавливаться - принимать электроны. Это происходит, если в реакции с ним будут участвовать щелочные металлы или кальций, у которых электроотрицательность меньше, чем у водорода.
- Обозначение - H (Hydrogen);
- Латинское название - Hydrogenium;
- Период - I;
- Группа - 1 (Ia);
- Атомная масса - 1,00794;
- Атомный номер - 1;
- Радиус атома = 53 пм;
- Ковалентный радиус = 32 пм;
- Распределение электронов - 1s 1 ;
- t плавления = -259,14°C;
- t кипения = -252,87°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 2,02/-;
- Степень окисления: +1; 0; -1;
- Плотность (н. у.) = 0,0000899 г/см 3 ;
- Молярный объем = 14,1 см 3 /моль.
Бинарные соединения водорода с кислородом:
Водород ("рождающий воду") был открыт английским ученым Г. Кавендишем в 1766 году. Это самый простой элемент в природе - атом водорода имеет ядро и один электрон, наверное, по этой причине водород является самым распространенным элементом во Вселенной (составляет более половины массы большинства звезд).
Про водород можно сказать, что "мал золотник, да дорог". Несмотря на свою "простоту", водород дает энергию всем живым существам на Земле - на Солнце идет непрерывная термоядерная реакция в ходе которой из четырех атомов водорода образуется один атом гелия, данный процесс сопровождается выделением колоссального количества энергии (подробнее см. Ядерный синтез).
В земной коре массовая доля водорода составляет всего 0,15%. Между тем, подавляющее число (95%) всех известных на Земле химических веществ содержат один или несколько атомов водорода.

В соединениях с неметаллами (HCl, H 2 O, CH 4 ...) водород отдает свой единственный электрон более электроотрицательным элементам, проявляя степень окисления +1 (чаще), образуя только ковалентные связи (см. Ковалентная связь).
В соединениях с металлами (NaH, CaH 2 ...) водород, наоборот, принимает на свою единственную s-орбиталь еще один электрон, пытаясь, таким образом, завершить свой электронный слой, проявляя степень окисления -1 (реже), образуя чаще ионную связь (см. Ионная связь), т. к., разность в электроотрицательности атома водорода и атома металла может быть достаточно большой.
H 2
В газообразном состоянии водород находится в виде двухатомных молекул, образуя неполярную ковалентную связь.

Молекулы водорода обладают:
- большой подвижностью;
- большой прочностью;
- малой поляризуемостью;
- малыми размерами и массой.
Свойства газа водорода:
- самый легкий в природе газ, без цвета и запаха;
- плохо растворяется в воде и органических растворителях;
- в незначительных кол-вах растворяется в жидких и твердых металлах (особенно в платине и палладии);
- трудно поддается сжижению (по причине своей малой поляризуемости);
- обладает самой высокой теплопроводностью из всех известных газов;
- при нагревании реагирует со многими неметаллами, проявляя свойства восстановителя;
- при комнатной температуре реагирует со фтором (происходит взрыв): H 2 + F 2 = 2HF;
- с металлами реагирует с образованием гидридов, проявляя окислительные свойства: H 2 + Ca = CaH 2 ;
В соединениях водород гораздо сильнее проявляет свои восстановительные свойства, чем окислительные. Водород является самым сильным восстановителем после угля, алюминия и кальция. Восстановительные свойства водорода широко используются в промышленности для получения металлов и неметаллов (простых веществ) из оксидов и галлидов.
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
Реакции водорода с простыми веществами
Водород принимает электрон, играя роль восстановителя , в реакциях:
- с кислородом (при поджигании или в присутствии катализатора), в соотношении 2:1 (водород:кислород) образуется взрывоопасный гремучий газ: 2H 2 0 +O 2 = 2H 2 +1 O+572 кДж
- с серой (при нагревании до 150°C-300°C): H 2 0 +S ↔ H 2 +1 S
- с хлором (при поджигании или облучении УФ-лучами): H 2 0 +Cl 2 = 2H +1 Cl
- с фтором : H 2 0 +F 2 = 2H +1 F
- с азотом (при нагревании в присутствии катализаторов или при высоком давлении): 3H 2 0 +N 2 ↔ 2NH 3 +1
Водород отдает электрон, играя роль окислителя , в реакциях с щелочными и щелочноземельными металлами с образованием гидридов металлов - солеобразные ионные соединения, содержащие гидрид-ионы H - - это нестойкие кристаллические в-ва белого цвета.
Ca+H 2 = CaH 2 -1 2Na+H 2 0 = 2NaH -1
Для водорода нехарактерно проявлять степень окисления -1. Реагируя с водой, гидриды разлагаются, восстанавливая воду до водорода. Реакция гидрида кальция с водой имеет следующий вид:
CaH 2 -1 +2H 2 +1 0 = 2H 2 0 +Ca(OH) 2
Реакции водорода со сложными веществами
- при высокой температуре водород восстанавливает многие оксиды металлов: ZnO+H 2 = Zn+H 2 O
- метиловый спирт получают в результате реакции водорода с оксидом углерода (II): 2H 2 +CO → CH 3 OH
- в реакциях гидрогенизации водород реагирует с многими органическими веществами.
Более подробно уравнения химических реакций водорода и его соединений рассмотрены на странице "Водород и его соединения - уравнения химических реакций с участием водорода ".
Применение водорода
- в атомной энергетике используются изотопы водорода - дейтерий и тритий;
- в химической промышленности водород используют для синтеза многих органических веществ, аммиака, хлороводорода;
- в пищевой промышленности водород применяют в производстве твердых жиров посредство гидрогенизации растительных масел;
- для сварки и резки металлов используют высокую температуру горения водорода в кислороде (2600°C);
- при получении некоторых металлов водород используют в качестве восстановителя (см. выше);
- поскольку водород является легким газом, его используют в воздухоплавании в качестве наполнителя воздушных шаров, аэростатов, дирижаблей;
- как топливо водород используют в смеси с СО.
В последнее время ученые уделяют достаточно много внимания поиску альтернативных источников возобновляемой энергии. Одним из перспективных направлений является "водородная" энергетика, в которой в качестве топлива используется водород, продуктом сгорания которого является обыкновенная вода.
Способы получения водорода
Промышленные способы получения водорода:
- конверсией метана (каталитическим восстановлением водяного пара) парами воды при высокой температуре (800°C) на никелевом катализаторе: CH 4 + 2H 2 O = 4H 2 + CO 2 ;
- конверсией оксида углерода с водяным паром (t=500°C) на катализаторе Fe 2 O 3: CO + H 2 O = CO 2 + H 2 ;
- термическим разложением метана: CH 4 = C + 2H 2 ;
- газификацией твердых топлив (t=1000°C): C + H 2 O = CO + H 2 ;
- электролизом воды (очень дорогой способ при котором получается очень чистый водород): 2H 2 O → 2H 2 + O 2 .
Лабораторные способы получения водорода:
- действием на металлы (чаще цинк) соляной или разбавленной серной кислотой: Zn + 2HCl = ZCl 2 + H 2 ; Zn + H 2 SO 4 = ZnSO 4 + H 2 ;
- взаимодействием паров воды с раскаленными железными стружками: 4H 2 O + 3Fe = Fe 3 O 4 + 4H 2 .
В нашей повседневной жизни есть вещи, которые настолько распространены, что почти каждый человек знает о них. Например, всем известно, что вода - жидкость, она легко доступна и не горит, следовательно, она может гасить огонь. Но вы когда-нибудь задумывались почему это так?
Источник изображения: pixabay.com
Вода состоит из атомов водорода и кислорода. Оба этих элемента поддерживают горение. Итак, исходя из общей логики (не научной) из этого следует, что вода тоже должна гореть, верно? Тем не менее этого не происходит.
Когда происходит горение?
Горение -это химический процесс, в котором молекулы и атомы объединяются, при этом выделяется энергия в виде тепла и света. Чтобы что-нибудь сжечь вам потребуется две вещи - топливо как источник горения (например, лист бумаги, кусок дерева и т. д.) и окислитель (содержащийся в земной атмосфере кислород является основным окислителем). Также нам потребуется тепло необходимое для достижения температуры воспламенения вещества, чтобы начался процесс горения.
Источник изображения auclip.ru
Например, рассмотрим процесс сжигания бумаги с использованием спичек. Бумага в этом случае будет являться топливом, газообразный кислород, содержащийся в воздухе будет выступать в качестве окислителя, а температура воспламенения будет достигаться благодаря горящей спичке.
Структура химического состава воды
Источник изображения: water-service.com.ua
Вода состоит из двух атомов водорода и одного атома кислорода. Ее химическая формула Н2О. Теперь интересно отметить, что два составных элемента воды действительно легко воспламеняющиеся вещества.
Почему водород является горючим веществом?
Атомы водорода имеют только один электрон и поэтому легко соединяется с другими элементами. Как правило в природе водород встречается в виде газа, молекулы которого состоят из двух атомов. Этот газ очень реактивный и быстро окисляется в присутствии окислителя, что делает его легковоспламеняемым.
Источник изображения: myshared.ru
При сгорании водорода происходит выделение большого количества энергии, поэтому его часто используют в сжиженном виде для запуска в космос космических аппаратов.
Кислород поддерживает горение
Как упоминалось ранее, для любого горения необходим окислитель. Есть много химических окислителей, в их числе кислород, озон, перекись водорода, фтор и т.д. В качестве основного окислителя, который в избытке содержится в атмосфере Земли является кислород. Он как правило является основным окислителем в большинстве пожаров. Именно поэтому для поддержания огня необходим постоянный приток кислорода.
Вода тушит огонь
Вода может гасить огонь по ряду причин, одной из которых является то, что это негорючая жидкость, несмотря на то, что состоит из двух элементов, которые могут по отдельности создать огненный ад.
Вода - самое распространенное средство тушения пожаров. Источник изображения: pixabay.com
Как мы уже говорили ранее, водород легко воспламеняется, все что для этого нужно это окислитель и температура воспламенения для начала реакции. Так как кислород является самым распространенным окислителем на Земле он быстро соединяется с атомами водорода с выделением большого количества света и тепла, при этом образуются молекулы воды. Вот как это происходит:
Обратите внимание на то, что смесь водорода с небольшим объемом кислорода или воздуха взрывоопасна и называется гремучим газом, она сгорает чрезвычайно быстро с громким хлопком, что воспринимается как взрыв. Катастрофа дирижабля "Гинденбург" в 1937 г. в Нью-Джерси унесла десятки жизней в результате возгорания водорода, которым была наполнена оболочка дирижабля. Легкая воспламеняемость водорода и его взрывоопасность в сочетании с кислородом - это главная причина того, что мы не получаем воду химическим путем в лабораториях.